哈尔滨市2016年初中升学考试化学卷
可能用到的相对原子质量:H-l C-12 O-16 Na-23 S-32 Cl-35.5 Ba-137
一、2016哈尔滨中考化学选择题(1-27小题,每小题2分,共54分,每小题只有一个正确答案)
1.2016年5月31日,冰城美食狂欢节在“老道外中华巴洛克”开幕。下列特色美食中富含糖类和油脂的是( )

2.下列过程中主要发生物理变化的是( )

3.下列实验操作正确的是( )
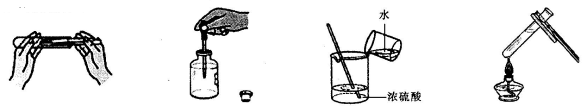
A.取用固体粉末 B.取少量液体 C.稀释浓硫酸 D.加热液体
4.下列物质的用途错误的是( )

A食品包装充氮气防腐 B活性炭吸附有毒气体 C 氧气作高能燃料 D二氧化碳作化工原料
5.下列做法正确的是( )
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
6.下列实验现象描述错误的是( )
A.红磷在空气中燃烧:产生大量白色烟雾及黄色火焰,放热
B.铝丝插入硫酸铜溶液中:银白色固体表面有紫红色固体析出,溶液由蓝色变为无色
C.将锌片放入少量稀硫酸中:银白色固体减少,固体表面产生气泡,放热
D.氯化铵与熟石灰混合研磨:白色固体中产生刺激性气味的气体
7.下列叙述、对应的化学方程式、所属基本反应类型都正确的是( )
A.电解水 2H2O通电 H2↑+O2↑ 分解反应
B.硫酸铜溶液中滴加氢氧化钠溶液 CuSO4 +2NaOH= Cu(OH)2↓ + Na2SO4 复分解反应
C.在空气中燃烧 2Mg + O2 点燃 2MgO 氧化反应
D.氢气还原氧化铜 H2 + CuO = Cu+H2O 置换反应
8.关注健康,预防疾病。下列有关说法错误的是( )
 A.健康人体血浆的pH范围在0.9-1.5
A.健康人体血浆的pH范围在0.9-1.5
B.幼儿及青少年缺钙会患徇偻病和发育不良
C.含氟牙膏可防治龋齿
D.缺乏维生素A会引起夜盲症
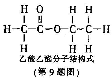
9.炒菜时加一点酒和醋能使菜味香可口,原因是有酯类物质生成。下列有关乙酸乙酯的叙述正确的是( )
A.乙酸乙酯是由碳、氢、氧元素组成的有机物
B.乙酸乙酯由碳、氢、氧原子构成
C.乙酸乙酯中碳、氧元素的质量比为2:1
D.乙酸乙酯中氧元素的质量分数最大
10.下列有关资源、能源的叙述正确的是( )
A.地壳中含量最高的金属元素是铜
B.石油炼制可得到汽油、煤焦油、航空煤油等
C.海洋中蕴藏着丰富的化学资源,海水中含有的化学元素有20多种
D.人们正在利用和开发的其他能源有氢能、太阳能、风能、地热能等
11.对下列事实的解释错误的是( )
选项 | 事实 | 解释 |
A | 用酒精温度计测量温度 | 分子间的间隔随温度的升降而增减 |
B | 用普通显微镜观察不到苯分子 | 分子很小 |
C | 氯化钠溶液能导电 | 溶液中有自由移动的带负电的电子 |
D | 夏天的食物比冬天易变质 | 温度越高,化学反应速率越快 |
12.区分下列各组物质的两种方法都正确的是( )
选项 | 需区分的物质 | 实验方法 |
A | 蒸馏水与5%过氧化氢溶液 | ①伸入带火星的木条②加入少量二氧化锰 |
B | 生铁与钢 | ①用磁铁吸引②加入到硫酸铝溶液中 |
C | 合成纤维与天然纤维 | ①点燃后用手指挤压灰烬②观察颜色 |
D | 食醋与糖水 | ①闻气味②测pH |
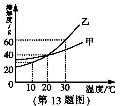 13.右图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
13.右图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.通过升温可以将甲的不饱和溶液变为饱和溶液
B.20℃时分别将甲、乙的溶液蒸发相等质量的水,析出甲、乙的质量相等
C.10℃时,10g水中分别溶解甲、乙达到饱和,溶解较多的物质是乙
D.把100g溶质质量分数为10%的乙溶液从30℃降温到10℃其质量分数仍为10%
14.除去下列各物质中少量杂质,所选用的试剂和操作方法均正确的是( )
选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
A | CaCO3(CaO) | 无 | 高温 |
B | H2O(植物油) | 洗涤剂 | 振荡、搅拌 |
C | CuO(铜粉) | 足量氧气 | 灼烧 |
D | KC1(KC1O3) | 二氧化锰 | 加热 |
15.实验室有98.5g碳酸钡样品(杂质既不溶于水,也不与酸反应),与100g氢元素质量分数为10%的稀硫酸恰好完全反应,则该样品中碳酸钡的质量分数为( )
A.12.5% B.19.7% C.20% D.25%
 二、2016哈尔滨中考化学非选择题(请根据题意填写空白,28-35小题,共40分gaosan.com}
二、2016哈尔滨中考化学非选择题(请根据题意填写空白,28-35小题,共40分gaosan.com}
28.(5分)“科技强则国家强”,今年5月习近平总书记来到黑龙江,在哈尔滨考察的第一站选在七O三研究所,了解小型燃气轮机研发情况。
(1)燃气轮机以天然气为燃料,天然气的主要成分是 (填化学式燃气轮机工作过程中的能量转化是从 能开始,最终转化为机械能。
 (2)为使天然气充分燃烧应考虑的因素是:燃烧时要有 ,这样可有效地减少 及炭粒、尘粒的排放,进而减少浮尘的形成。
(2)为使天然气充分燃烧应考虑的因素是:燃烧时要有 ,这样可有效地减少 及炭粒、尘粒的排放,进而减少浮尘的形成。
(3)轮船制造业一般会用到硬铝,主要利用它的 等性能(填字母)。
A.光泽好、密度大 B.强度和硬度好 C.导电、导热性好
29.(5分)日前哈市首个蔬菜物联网基地在双城蔬菜园区建成投入使用。
(1)蔬菜大棚所用的聚乙烯薄膜属于____________ (填字母)。
A.合成材料 B.金属材料 C.复合材料
(2)为了适应北方春季低温气候,在种植叶类蔬菜时适宜施加的一种复合肥是 (填化学式gaosan.com)。氮肥有促进植物茎、叶生长茂盛, ,提高植物蛋白质含量的作用。
(3)蛋白质是构成细胞的基本物质,是 及修补受损组织的主要原料。通过食物获得的蛋白质和
(填化学式)等进入人体内都会先与水发生反应。
30(3分)下图是氢气在氯气中燃烧生成氯化氢的微观模拟图,请回答下列问题:

(1)在B图中将相关粒子图形补充完整;
(2)此变化前后发生改变的粒子是 ;
(3)从微观角度解释此反应为化合反应的原因是 。
31(4分)分类、类比是学习化学常用的方法。
(1)化学实验可按其主要目的分为:探究物质的性质、混合物的分离提纯、探究物质的含量等据此应将下列实验中的B与 (填“A”或“C”或“D”)归为一类,依据是 。
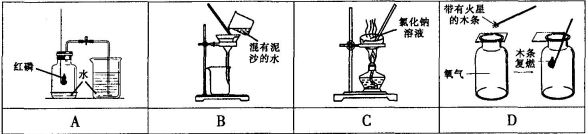
(2)在反应C+CO2高温2CO中,具有氧化性的反应物是 。请写出一个两种化合物发生反应的化学方程式(其中一种化合物体现氧化性,另一种化合物体 现还原性)
32(7分)实验室现有高锰酸钾、稀盐酸、火柴、木块、棉花、药匙、镊子及以下仪器:
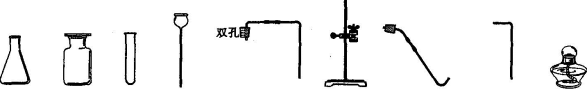
 (1)若补充两种药品 和 (填名称),可制取并检验一种气体。
(1)若补充两种药品 和 (填名称),可制取并检验一种气体。
(2)若补充一种仪器 (填名称),还能制备并收集另一种气体,反应的化学方程式为 。
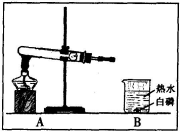
(3)如右图所示:
①请连接A、B,使热水中的白磷燃烧,并将装置图补充完整。
 ②热水中的白磷能燃烧是因为试管内反应生成气体,管内气体增多,同时温度升高,压强 ,大于外界大气压,在 的作用下,气体逸出与白磷反应。
②热水中的白磷能燃烧是因为试管内反应生成气体,管内气体增多,同时温度升高,压强 ,大于外界大气压,在 的作用下,气体逸出与白磷反应。
③停止加热时,先要 然后再 。
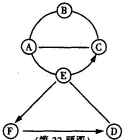
33(4分)右图中A、B、C、D、E、F分别表示六种物质,B、C、D、F分别属于酸、碱、盐、氧化物四种类别中的一种,A是目前世界年产量最髙的金属,B是可溶性银盐,D与
E发生的反应属于中和反应。(图中用“--”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质,部分反应物和生成物及反应条件已略去,图中部分反应需在溶液中进行)。请回答下列问
(1)分别写出B、C、E、F物质的化学式(或溶质的化学式)。
B: C: E: F: ;
(2)写出A与B发生反应的化学方程式
(3)写出B与C发生反应的实验现象
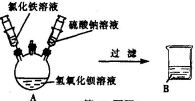 34.(6分)某化学活动小组在一次实验中进行了如图所示实 验:先向A中注入一定量氯化铁溶液,再注入一定量硫酸钠溶液,此过程中观察到的现象是(1) 。小组同学对无色溶液B产生了浓厚的兴趣,进行了进一步的探究活动。
34.(6分)某化学活动小组在一次实验中进行了如图所示实 验:先向A中注入一定量氯化铁溶液,再注入一定量硫酸钠溶液,此过程中观察到的现象是(1) 。小组同学对无色溶液B产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】B中含的离子有什么?
【实验探究gaosan.com】
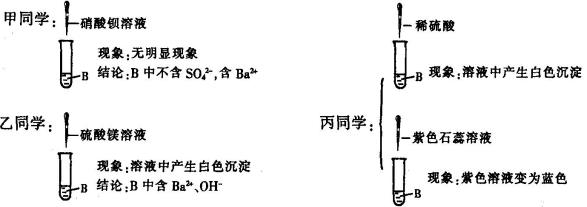
【评价交流】甲同学结论(2) (填“正确”或“错误”);乙同学的探究过程不正确,理由是(3) 。
【实验结论】结合上述实验最终确定B中含有(4) (填离子符号),不含(5) (填离子符号)。
【归纳总结】由甲、乙、丙同学实验对比得出,确定溶液中可能存在的不同离子是否存在的方法是:可根据待测离子与所加试剂反应(6)
确定出存在的离子,同时推测出与(7)
35.(6分gaosan.com)为测定某敞口放置的氢氧化钠溶液的变质情况,某同学实验并记录如下:
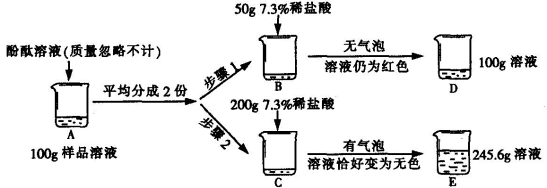
(1)配制上述实验所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是 ;
(2)B烧杯中发生反应的化学方程式为 ;
(3)根据巳知条件求解C烧杯溶液中碳酸钠质量(x)的比例式为 ;
(4)向E烧杯内加入54.4g水,所得不饱和溶液中溶质的质量分数为 ;
(5) D烧杯溶液中溶质的化学式为 ;
(6)原氢氧化钠溶液中变质的氢氧化钠与未变质的氢氧化钠质量比为
哈尔滨市2016年初中升学考试 综合试题参考答案及评分标准 (化学部分)
说明:化学方程式中条件、配平答错或没答扣一半分,化学式错误不得分。化学名词错误不得 分。沉淀符号、气体符号、字母书写不准确及非化学名词的错别字、漏字等错误3处扣1分, 但不重复扣分。简答问题其它答法合理的酌情给分。
—、2016哈尔滨中考化学选择题(1-15小题,每小题2分,共30分)
1-5 BCACB 6-10 ABAAD 11-15 CDDCD
二、2016哈尔滨中考化学非选择题(28—35小题,共40分)
28(1)CH4(1分)化学(1分)足够的空气(1分)未燃烧的碳氢化合物(1分)B(1 分)
29(5分)(1)A(1分)NH4H2PO4[或(NH4)2HPO4]( 1分)叶色浓绿(1分)机体生长(1分)(C6H10O5)n(1分)
30(3分)(1)如图所示(1分)
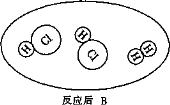
(2)氯分子和参加反应的氢分子(1分)
(3)两种分子反应生成另一种分子(1分)
31(4分)(1)C(1分)都是混合物的分离提纯(1分)(2)CO2(1分)CO + CuO△ Cu + CO2(合理即可)(1分)
32(7分)(1)石灰石(或大理石)(0.5分)澄清的石灰水(0.5分)水槽(1分)2KMnO4 △K2MnO4 + MnO2+O2↑ (1分)
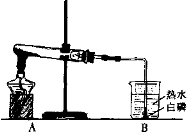 (3)① 画图要求:画固体(固体平铺在试管底部);画导管(在棉花和胶塞间画短导管);画直角导管(左端接胶管,右端伸人 水中,对准白磷);画火焰(白磷上方画火 焰)。(2分,每一处0.5分)
(3)① 画图要求:画固体(固体平铺在试管底部);画导管(在棉花和胶塞间画短导管);画直角导管(左端接胶管,右端伸人 水中,对准白磷);画火焰(白磷上方画火 焰)。(2分,每一处0.5分)
②增大(0.5分)压强差(0.5分)③把导管移出水面(0.5分)熄灭酒精灯(0.5分)
33(4分)(l)B:AgNO3(0.5分) C:HC1(0.5分)E:H2SO4(0.5分)F:H2O(0.5分)
Fe + 2AgNO3 = 2Ag + Fe(NO3)2(1分)溶液中产生白色沉淀(1分)
34(6分)(1)溶液中先产生红褐色沉淀,后产生白色沉淀(1分)
(2)错误(0.5分)(3)Mg(OH)2、BaSO4均为白色沉淀(0.5分),溶液中含Ba2+,OH-中的一种或两种加入MgSO4溶液都会产生白色沉淀,所以不能得出B中含Ba2+OH-的结论(0.5分) (其他答法合理的酌情给分)
(4)Na+、Cl-、Ba2+、OH-(l分)(0.5分)(5)Fe3+、SO42-(1分)
(6)产生不同的明显现象(1分)(其他答法合理的酌情给分)
(7)确定存在的离子能反应的离子不存在(0.5分)(其他答法合理的酌情给分)
35(6分)⑴50g(l分)(2)NaOH + HC1 = NaCl+H2O(1分)(合理即可)(1分)(3)106/44=X/4.4g(4)7.8%(1分)(5)NaOH、Na2CO3、NaCl(l 分)(6)1:1(1分)

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...