![]()

欢迎参加中考,相信你能成功!请先阅读以下几点注意事项:
1.试卷分为第一部分、第二部分两部分,共6页,全卷满分60分.考试时间60分钟。
2.第一部分每小题选出答案后,请用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,先用橡皮擦干净后,再选涂其它答案,答案写在本试卷上无效。
3.做第二部分时,用0.5毫米黑色墨水签字笔,将答案写在答题卡上相应题号后的积线上。答案写在本试卷上或答题卡上规定的区域以外无效。
4.考试结束后,将本试卷和答题卡一并交回。
5.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 C1-35.5 K-39 Fe- 56 Zn-65 Ba-137
第一部分 (选择题共20分)
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.下列属于化学变化的是
A.瓷碗破碎 B.粮食酿酒 C.甘蔗榨汁 D.白醋挥发
2.下列食物中富含蛋白质的是
A.牛奶 B.黄瓜 C.大米 D.豆油
3.下列操作正确的是
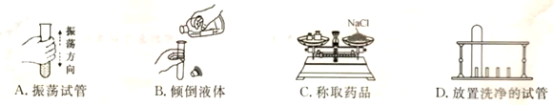
4.氢氟酸(HF)可用于在玻璃上雕刻各种精美图案,发生反应的化学方程式可表示为SiO2+4HF=X↑+2H2O,则物质X为
A. SiO B. O2 C. SiF4 D. SiF
5.下列物质中,计人“空气污染指数”的是
A.氧气 B.氮气 C.二氧化碳 D.可吸人颗粒物
6.下列符号中,能表示2个氢离子的是
A. H2 B.2H C.2H+ D. H2+
7.下列物品所用的材料属于合成材料的是
A.塑料直尺 B.羊绒围巾 C.铝合金门 D.玻璃水杯
8.“绿色发展”、“低碳生活”等理念逐渐深入民心,下列做法值得提倡的是
A.露天焚烧垃圾 B.回收和利用废金属
C.填埋废旧电池 D.鼓励开私家车出行
9.如图是甲、乙两固体物质(不含结晶水)的溶解度曲线,下列说法不正确的是
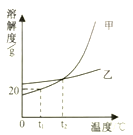
A.t1℃时,向50g水中加入10g甲,所得溶液可以达到饱和状态
B.采用升高温度的方法,可使乙的饱和溶波变为乙的不饱和溶液
C.甲中混有少量乙,可以采用冷却热的饱和溶液的方法提纯甲
D.t2℃时,将甲、乙两容液热发等质量的水.析出晶体质量一定相等
10.下列实验操作能达到实验日的的是
选项 | 实验目的 | 实验操作 |
A | 检验二氧化碳中混有的少量氧气 | 将带火星的木条伸入混合气体中 |
B | 除去碳酸钠固体中混有的氯化钠 | 加入足量的稀盐酸蒸发结晶 |
C | 比较相同条件下肥皂水和稀氨水的碱性强弱 | 分别用玻璃棒董取试样,滴在pH试纸上,把试纸呈现的颜色与标准比色卡对照 |
D | 探究氢氧化钠溶液和稀硫酸是否恰好完全反应 | 向反应后的溶被中滴加无色酚酞试液 |
第二部分 (非选择题 共40分)
二、填空与简答题(本题共5小题,共18分)
11.(4分)用符合要求的物质的序号填空。
①氯化钠 ②小苏打 ③干冰 ④武德合金
(1)可用于治疗胃酸过多的是____________。
(2)可用于制保险丝的是____________。
(3)可用于配制生理盐水的是____________。
(4)可用于人工降雨的是____________。
12. (4分)水与我们密切相关,请回答:
(1)自然界中的水属于____________ (填“纯净物”或“混合物”)。
(2)日常生活中常用_____________的方法来降低水的硬度。
(3)实验室中常用水作溶剂,列物质分散在水中能形成溶液的是________ (填序号)。
A.泥土 B.蔗糖 C.食用油
(4)工业上用水和甲烷(CH4)在一定条件下反应生成 一氧化碳和氢气。该反应的化学方程式为____________。
13.(3分)铁是目前使用最广泛的金属,请回答:
(1)饮可以用来制作炊具,这是利用了铁的____________性。
(2)相比于黄铁矿(主要成分FeS2),工业上选赤铁矿(主要成分Fe2O3)为原料炼铁的优点是______。
(3)金属腐蚀造成的损失巨大,钢铁防腐尤为重要,下列钢铁制品的防护措施不合理的是____________(填序号)。
A.在车船的表面喷涂油漆 B.将使用后的菜刀用布擦干
C.在铁制品表面镀上一层锌 D.用洗涤剂把铁制品表面的油污洗净
14. (4分)化学的特征是在原子、分子水平上研究物质和创造物质。请从微观角度回答:
(1)“遥知不是雪,为有暗香来”。花香入鼻的原因是_____________。
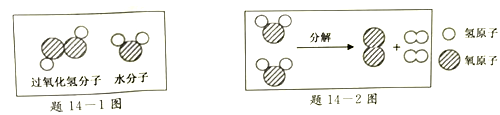
(2)由题14-1图推知水和过氧化氢化学性质不同的原因是_______。
(3)由题14 -2图可知,水分解过程中,没有发生变化的微粒是_______(填微粒符号)。
(4)N(NO2)3是一种新型火箭燃料,N(NO2)3中N、O原子个数比是______。
15.(3分)小芳以化合价为纵坐标、物质类别为横坐际绘制了题15图。A、B、C、D、E 是初中常见物质。且都含氧元素,各物质中均有某种组成元素的化合价与纵生标的数值相对应。“→”表示物质间的转化关系,其中B通常为无色无味气体,D的水溶液呈蓝色,请回答:
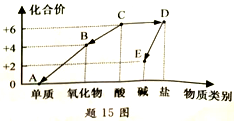
(1)物质C的化学式是______。
(2)D→E的基本反应类型是_______。
(3)B→A的化学与程式是_______。
三、实验与探究题(本题共5小题,共16分)
16.(4分)根据题16图网答下列问题。
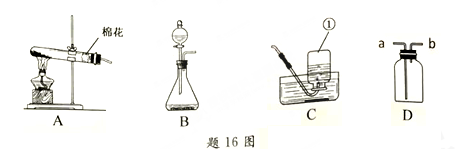
(1)图中标有序号①的仪器名称是___________。
(2)实验空中高锰酸钾制取氧气反应的化学方程式是______,应选择的发生装置是______ (填序号)。
(3)若用D装置收集氢气,则气体应从_____填“a”或“b”)端进入。
17.(6分)某课外活动小组进行如下实验探究。

(1)验证物质的然烧条件
根据题17-1图进行实验,实验现象如图所示。
①80℃热水的作用是__________。
②比较现象a、c,得出燃烧的条件是___________。
(2)验证锌与铁的金属活动性
①相同条件下,取等质量锌粉、铁粉,根据题17- 2图进行实验,实验过程中,观察到锌 粉表面产生气泡的速率比铁粉快,由此得到的结论是__________。
②实验结束后,发现∪形管两边的金属粉末均无剩余,则硫酸剩余的情况可能是__________ (填序号)。
A.左、右两边均有剩余 B.左边有剩余,右边无剩余
C.左、右两边均无剩余 D.左边无剩余,右边有剩余
(3)测定水中氢氧元素的质量比(已知H2+CuO![]() Cu+H2O)
Cu+H2O)
根据题17-3图进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。
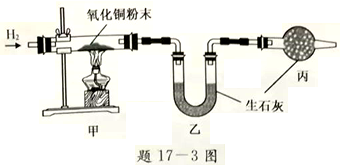
①水中氢、氧元素的质量比是______(用含 a、b的式子表示)。
②下列因素中,对测定结果有影响的是________(填序号)。
A.CuO粉末不干燥 B. CuO没有完全转化为Cu
C.没有丙装置
18. (6分)水垢是日常生活中常见的物质,某兴趣小组收集了一部分水垢[主要成分CaCO3和Mg(OH)2,不考虑其他成分对实验的影响]并对其进行实验探究。
【查阅资料】①Mg(OH)2受热易分解,生成MgO和H2O;
②无水硫酸铜是白色固体,遇水变蓝色。
【探究活动一】验 证水垢中的CaCO3和Mg(OH)2
(1)小斌取一定量水垢样品,高温灼烧,将生成的气体依次通过澄清石灰水和无水硫酸铜,观察到澄清石灰水变浑浊、无水硫酸铜变____色。
得出结论:水垢中含CaCO3和Mg(OH)2。
(2)小红提出小斌的实验方案存在明显缺陷,小红的理由是______。
【探究活动二】分离水垢中的CaCO3和Mg(OH)2
小林设计了如下实验流程(部分产物已略去):
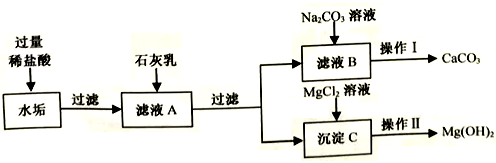
(1)过滤用到的玻璃仪器有烧杯、玻璃棒和__________。
(2)滤液A中的溶质有_________ (用化学式表示)。
(3)加入MgCl2溶液时,发生反应的化学方程式是_________。
(4)操作II的实验步骤是__________。
四、计算题(本题共1小题,共6分)
19. (6分)对销售的化肥,国家有明确的质量要求。某兴趣小组对市售的某钾肥进行了检测,称取2. 0g样品放入烧杯中,加入适量的水溶解后,逐滴加入10%的BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如题19—1 图所示(假定杂质不象加反应)。
已知:K2S04+ BaCl2=BaSO4↓+2KC1。

(1)20. 8g BaCl2溶被中所含溶质的质量为____g。
(2)通过计算,判断该钾肥中K2SO4的质量分数是否符合题19— 2 图的包装说明? (写出计算过程)

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...