绝密★启用前 试卷类型: A

温馨提示:
1.本卷共7页,共70分,考试时间80分钟。
2.所有答案必须涂写在答题卡上,写在试卷中的答案无效。
3.考试结束后,本试卷和答题卡一井交回。
4.可能用到的相对原子质量:H-I C-12 0-16 Na-23 Mg-24 Cl-35.5 Ca-40 Fe-56 Cu-64 2n-65 Ag-108 Ba-137
美丽中国!美丽化学!
化学是在原子、分子层次上总管物质变化之科学。化学工作者敬畏自然,取舍有度,掌控变化,改造物质。
凭“化学眼”观物质,用“化学语”表物质,藉“化学法”造物质。化学让生活更美好,人与自然更和谐!
亲爱的同学,化学向你招手,自然对你微笑,祖国等你建设。加油!
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.据《中国环境报》报道,为应对气候变化,落实《巴黎气候变化协定》,2017年国家建立了统一的碳排放权交易市场,按国际惯例,这里的“碳”是指
A.二氧化碳 B.单质碳 C.碳元素 D.所有含碳化合物
2.下列能够反映物质组成的概念是
①溶解度 ②元素 ③溶质质量分数 ④有机物 ⑤溶液
A.①②③④⑤ B.②③④⑤ C.②③ D.②
3.石墨烯是一种革命性材料,具有优异的光学、电学和力学特性。下图为金刚石、石墨和石墨烯的结构模型图,图中小球代表碳原子。下列说法正确的是
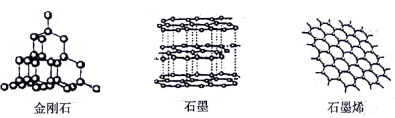
①石墨烯是一种新型化合物
②三种物质分别在足量的氧气中完全燃烧的产物相同
⑨金刚石和石墨烯是组成相同但结构不同的两种物质
④石墨烯有超强的导电性和导热性,说明石墨烯的化学性质和金属相似
A.①④ B.②③ C.①③ D.②③④
4.对立统一是物质运动的普遍规律,下列①一④描述的是两种物质的性质业变化,其中属于物质的物理性质或物理变化的是
①氧气的氧化性和一氧化碳的还原性 ②水的气化和氦气的液化
③氯化钠的溶解和硝酸钾结晶 ④盐酸的酸性氢氧化钠的碱性
A.②③ B.②④ C.①④ D.①③
5.描述物质变化的成语有:①滴水成冰;③死灰复燃;③木已成舟;④火烧赤壁;⑤沙里淘金;⑥火上浇油;⑦百炼成钢;⑧花香四溢;⑨玉石俱焚,其中属于化学变化的是
A.②③④⑤⑥⑦ B.④⑤⑥⑦⑨ C.①③④⑤⑧⑨ D. ②④⑥⑦⑨
6.在化学变化中,下列说法正确的是
①原子的种类、元素的种粪、分子的种类均不变
②原子的数目、分子的数目均不变 .
③原子的质量、元素的质量、物质的总质量均不变
④原子核的种类、数量、质量均不变
A.①② B.①③ C.③④ D.②④
7.材料是时代进步的标志。下列关于材料的说法错误的足
A.塑料属于有机合成高分子材料 B.玻璃属于硅酸盐材料
C.制造芯片的硅属于非金属材料 D.铝镁合金属于复合材料
8.绿水青山就是金山银山。关于化学、物质、人类活动和环境问题的认识,合理的是
A.化学是环境污染的主因,没有化学,就不会产生环境问题
B.有毒的化学物质是环境污染的主因,应禁止使用
C.解决环境问题,应从源头禁止排放污染物,而不应先排放后治理
D.化工生产是环境污染的主因,化工生产一定会导致环境污染
9.下列四个图像分别对应四个变化,其中正确的是

A.将水通电一段时间后
B.向氢氧化钾和碳酸钾的混合溶液中滴加过量稀盐酸
C.向一定质量分数的氢氧化钠溶液中不断加水
D分别向等质量的铁粉和锌粉中加入过量的相同质量分数的稀硫酸
10.以下是实验室制取、收集、干燥、存放气体的装置图,有关说法错误的是
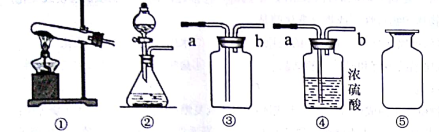
① ② ③ ④ ⑤
A.实验室用双氧水制取氧气,用石灰石和稀盐酸制取二氧化碳均可使用装置②
B.实验室收集氧气和二氯化碳均可使用装置③,气体从导管b进入
C.实验室干燥氯气和二氧化碳均可使用装置④,气体从导管a进入
D.实验室收集的氯气和二氧化碳,均可如图⑤临时存放
二、填空与简答(本大题共5小题,共33分)
11.(5分)征服原子——揭开原子的神秘面纱
伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是——一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。
(1) 1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
1811年,意大利化学家阿伏伽德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
1897年,汤姆森通过实验发现了___________,进一步发展了原子.分子论。汤姆森主要是纠正了“道尔顿原子论” _________中的观点。
1911年,声瑟福又通过实验,推测原子是由_________构成,并提出了沿用至今的现代原子结构理论。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆森和卢瑟福这样.对实验现象进行解释的过程叫做____。
原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了 _________来表达他们的理论成果。
阅读下面材料,回答12-15题。
人类赖以生存的环境由自然环境和社会环境组成。自然环境由生物圈、岩石圈、大气圈、水圈组成(如图1所示),四个圈层经过漫长演化,既相对稳定、动态平衡,又相互作用、不断变化,各圈层之间的物质和能量不停循环,这些循环既跟物质的组成、结构和性质有关,也受人类活动的影响,并通过复杂的物理变化和化学变化实现。
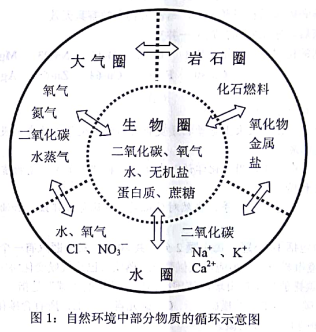
12.(6分)内涵决定身份——物质的组成与分类
(l)用化学符号填空:
岩石圈中含量最高的金属元素是_______。大气圈中含量最高的物质是_______。水圈中含量最高的元素是_______。土壤中能促进农作物根系发达的元素是____。
(2)按要求填表:
物质所属圈层 | 物质名称 | 物质的化学式 | 用符号表示构成物质的微粒 | 物质类别 |
生物圈 | 蔗糖 |
|
|
|
大气圈 | 氩气 |
|
|
|
水圈 | 氢氧化钙 |
|
|
|
岩石圈 |
|
| Na+、SiO32- |
|
13.(11分)甲烷——小分予,大作为
在图1的四大圈层中,有下列6种物质:①甲烷;②水;③二氯化碳;④一氧化碳;
⑤氢气;⑥氧气。构成这些物质的分子虽然简单,但这些物质有的是人类赖以生存的基本物质,有的是物质循环关键物质,有的是人类社会生产活动必需的物质。请回答:
(1)在这6种物质中,元素种类共有____种,人类的生命活动不可缺少的物质有(填化学式,下同)____,植物生长必需的物质有____,元素种类完全相同的物质是____。
(2)甲烷是最重要的基础有机物之一,不仅可做燃料,还能发生如下反应:
①在隔绝空气和1000℃条件下,甲烷分解产生炭黑和氢气;
②在隔绝空气和1500℃条件下,甲烷分解产生乙炔和氢气;
③在1400℃条件下,适当比例的甲烷和氧气反应生成氢气和一氧化碳;
④在800℃和催化剂条件下,适当比例的甲烷和二氧化碳反应生成氢气和一氧化碳。
试写出上述②~④三个反应的化学方程式:
②_________________________;
③_________________________;
④_________________________;
(3)在反应①~④中,属于置换反应的有_________________________。
在反应①和②中,反应物相同,而生成物不同,从微观的角度看,是因为反应条什不同导致________。
③和④两个反应的反应物不同,但生成物相同,从物质组成的角度看,其原因是________。
在实际生产:中,反应③需要按比例控制氧气不能超量,从物质性质的角度看,原因是_________。
14.(5分)柔之力——神奇的水溶液
水在生活、生产和科学实验中应用广泛。岩石圈约有四分之三被水覆盖,其中的某些物质被水溶解,其随水的天然循环在水圈中富集,富集后的物质可能再次沉积到岩石圈。
图2是氯化钠和碳酸钠的溶解度曲线。据图回答下列问题:
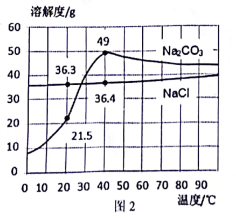
(1)青海湖区的人们有一种经验,冬天捞“碱”、夏天晒盐,这里的“碱”指纯碱,盐指氯化钠,他们所依据的原理是____________。
(2)纯碱是一种重要的化工原料,但仅用物理方法从盐湖中“捞碱”远远不能满足需求,工业上主要利用从水圈中获得的食盐来制备纯碱,其反应的化学方程式是____、_______。
(3)为确定某白色周体是碳酸钠还是氯化钠,在20℃时,取2.5g样品加入盛有10g水的烧杯中,充分搅拌后现象如图3所示,则固体粉末是________。若将该溶液升温到40℃时,则所得溶液溶质质量分数为__________。

15.(6分)金属——工业的脊梁
金属及合金广泛应用于生活、生产和航天军工。
资料:水圈和岩石圈中含有丰富的镁元素。工业生产中,可用菱镁矿做原科制'备金属镁,流程如图4所示:
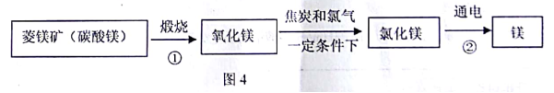
请回答下列问题:
(l)已知①和②属于分解反应,化学方程式分别为_________和___________。
(2)通过化学反应,以岩石圈的矿石为原料还可以制备很多其他金属,请举一例说明(用化学方程式表示其制备原理)______________。
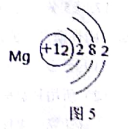
(3)图5是镁原子结构示意图,镁化学性质活泼,原因是________。四大圈层中含有下列物质:①硫酸锌;②氯化钠;③硫酸;④氢氧化钙;⑤氧气。其中能和铁反应的物质有(填序号)________。
(4)小梅同学将点燃的镁条伸入盛二氧化碳的集气瓶中,看到镁条剧烈燃烧,发出耀眼白光,瓶壁上有黑色物质生成,她认为这种黑色物质是碳单质。在上述过程中,小梅运用的科学方法有______________。
三、实验与探究(本大题共l小题,共I2分)
16. (12分)某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
定性检验
(1))要确定该产品中是否含有杂质氯化钠,你的方法是_________________。
定量测定
(2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是(用化学疗程式表示)_______________________________。
(3)假设你取样的质量为m1,根据你确定的反应原理,你需要通过实验测量沉淀(填化学式)____的质量(假设你测得的沉淀的质量为m2)。
(4)请你设计实验方案,获得数据m1、m2,把方案填在下表中。
适用的仪器名称 | 实验步骤 |
|
|
(5)数据处理:
请用含m1、m2的式子表示所测样品中碳酸钠的质量分数。
______________________。
分析讨论
(6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。除沉淀法外,还可依据反应(用化学方程式表示)_______________来测定该纯碱样品中碳酸钠的质量分数。
四、计算(本大题共l小题,共5分)
17.(5分)向20g,铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请计算:
(l)合金中锌的质量分数为____。
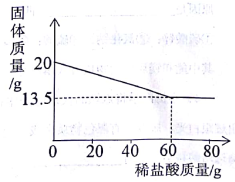
(2)所用稀盐酸的溶质质量分数。(计算结果保留一位小数)
绝密★启用前 试卷类型.A

一、选择题(本大露包10小题,每小照2分,共20分.)
1-5:ABBAD 6-10:CDCDB
二、填空与简答(共33分)
11.(评分标准:共5分,每空1分)
(l)电子 原子不可再分 原子核和核外电子 (2)推理 模型
12.(评分标准:共6分,第(1)小题每空0.5分,第(2)小题每行1分)
(l) Al N2 O P
物质所属圈层 | 物质名称 | 物质的化学式 | 微粒符号 | 物质类别 |
生物圈 |
| C12H22O11 | C12H22O11 | 有机物 |
大气圈 |
| Ar | Ar | 单质 |
水圈 |
| Ca(OH)2 | Ca2+、OH- | 碱 |
岩石圈 | 硅酸钠 | Na2SiO3 |
| 盐 |
13.(评分标准:共l1分,每空1分.第(1)小题漏填、多填均不得分)
(1)3 H2O、O2 CO2、H2O、O2 CO、CO2
1500℃
(2)②2CH4 ![]() C2H2+3H2
C2H2+3H2
③2CH4+O2![]() 4H2 +2CO ④CH4+ CO2
4H2 +2CO ④CH4+ CO2 ![]() 2H2 +2CO
2H2 +2CO
(3)③ 原子的结合方式不同
反应物的组成元素相同,反应前后元素的种类不变(只答对前半句给0.5分,只答对后半句话给满分)
在1400℃时,超量的氧气能与生成物(或氢气、一氧化碳)反应
14.(评分标准:共5分,每空1分)
(1)氯化钠溶解度受温度影响较小,夏天温度高,加快水分蒸发,氯化钠容易结晶析出。碳酸钠溶解度受温度影响较大,冬天温度低,易结晶析出。
(2) NaCl+NH3 +CO2+H2O=NaHCO3+NH4Cl
型垦Na2c
2 NaHCO3 ![]() Na2CO3+ CO2↑+H2O
Na2CO3+ CO2↑+H2O
(3) Na2CO3 20%
15.(评分标准:共6分,每空1分)
(1) MgCO3![]() MgO+ CO2↑ MgC12
MgO+ CO2↑ MgC12 ![]() Mg+C12↑
Mg+C12↑
(2)一氧化碳还原氧化铁(或四氧化三铁),或电解氧化铝的方程式。合理即可。
(3)镁原子最外层电子数为2.在化学反应中易失电子 ①③⑤(答2个得0.5分)
(4)实验、观察、推理 (答2个得0.5分)
三、实验与探究(共12分)
16.(评分标准:共12分)
(l)答案要点:样品需溶解,交代清楚试剂、现象和结论.(2分,每2个要点1分)
(2) Na2CO3+BaCl2=BaCO3↓+2NaCl (2分)(只选对试剂1分,其它答案合理也可)
(3) BaCO3 (或CaCO3) (1分)(使用其他试剂,答案合理也可)
(4)
选用的仪器名称 | 实验步骤 |
烧杯、玻璃棒、胶头滴管、铁架台(带铁圈)、漏斗、托盘天平(或电子秤)、(洗瓶、干燥仪器)(共2分,每3个仪器1分,每答对2个仪器给0.5分.不答洗涤、干燥仪器不扣分) | 答案要点: ①称量样品的质量 ②溶解; ③加试剂(需指明试剂过量或足量); ④过滤 ⑤洗涤、干燥 ⑥称量沉淀的质量 (共3分·每答对1个要点给0.5分) |
(其他合理答案也可,如:使用含钙离子试剂或氯化银沉淀法)

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...