![]() 2018年济宁中考化学冲刺试卷【精选word版 含答案】
2018年济宁中考化学冲刺试卷【精选word版 含答案】
由于格式问题,部分试题会存在乱码的现象,请考生点击全屏查看!
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 Ca—40 Cl—35.5 Zn—65 Fe—56 Ag—108
第Ⅰ卷(选择题 16分)
一、选择题(下列各题中只有一个正确选项。其中,1~4小题各1分,5~10小题各2分,共16分。请将答案填写在第Ⅱ卷的答题栏里。)
1. 下列图中所示过程发生化学变化的是( )

A. B. C. D.
![]() 2. 下列化学用语关于数字“3”的意义,说法正确的是( )
2. 下列化学用语关于数字“3”的意义,说法正确的是( )
①3Ag ②Fe3+ ③SO3 ④NaNO2 ⑤3O2﹣ ⑥3P2O5
A. 表示离子所带电荷数的是②⑤
B. 表示分子个数的是①
C. 表示一个分子中原子个数的③⑥
D. 表示化合价数值的是④
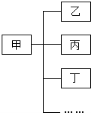 3. 分类是化学学习和研究的一种常用科学方法,小红用如图形式对所学知识进行归纳,其中甲包含乙、丙、丁……下列关系中,有错误的一组是( )
3. 分类是化学学习和研究的一种常用科学方法,小红用如图形式对所学知识进行归纳,其中甲包含乙、丙、丁……下列关系中,有错误的一组是( )
A. 盐 食盐、纯碱、高锰酸钾
B. 合金 不锈钢、焊锡、生铁
C. 溶液 碘酒、糖水、生理盐水
D. 干燥剂 石灰石、浓硫酸、生石灰
4. 从分子的角度分析并解释下列事实,说法不正确的是( )
A. 冰不容易分割,水易分割 冰中水分子间作用力大
B. 糖水是混合物 由不同的分子构成
C. 可燃冰变为天然气 状态变化,分子大小随之变化
D. 水通电分解 分子在化学变化中可分
![]() 5. 下列化学方程式的书写与事实相符的是( )
5. 下列化学方程式的书写与事实相符的是( )
A. 铁丝在氧气中燃烧 4Fe+3O2 2Fe2O3
![]() B. 除去铜粉中少量铁粉的方法之一 2Fe+6HCl 2FeCl3+3H2↑
B. 除去铜粉中少量铁粉的方法之一 2Fe+6HCl 2FeCl3+3H2↑
![]() C. 向碳酸钙中加氯化钡溶液 CaCO3+BaCl2 BaCO3↓+2CaCl2
C. 向碳酸钙中加氯化钡溶液 CaCO3+BaCl2 BaCO3↓+2CaCl2
![]() D. 医疗上可用小苏打治疗胃酸过多 NaHCO3+HCl NaCl+H2O+CO2↑
D. 医疗上可用小苏打治疗胃酸过多 NaHCO3+HCl NaCl+H2O+CO2↑
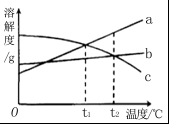
6. a、b、c 三种物质的溶解度曲线如下图所示。取等质量t2℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至t2 ℃。下列说法不正确的是( )
A. 原饱和溶液中,溶质的质量分数 a>b=c
B. 恢复至 t2℃时,析出溶质的质量 a>b=c
C. 恢复至t2℃时,三种溶液一定都是饱和溶液
D. 若继续降温至 t1℃,三种溶液一定都是饱和溶液
7. 把二氧化碳、一氧化碳、氢气和氮气混合气体通过石灰水,灼热的氧化铜(假设每个过程中发生的化学反应充分),冷却后留下的气体是( )
二氧化碳和氮气 B. 氮气和水蒸汽
C. 一氧化碳和二氧化碳 D. 氮气和氢气
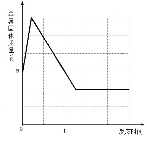
8. 将一定质量的Zn粉加入一定质量的AgNO3和Fe (NO3)2的混合溶液,得到的固体质量随时间的变化关系如图所示.下列说法不正确的是( )
A. 当反应进行到t时,所得金属固体中的物质至少有两种
B. 当反应进行到t时,取反应后的滤液滴加稀盐酸,有白色沉淀产生
C. 当反应进行到t时,此时取滤渣滴加稀盐酸,一定有气泡产生
D. 当反应进行到t时,取反应后的滤液观察,滤液呈浅绿色
9. 下列有关物质的提纯、除杂和鉴别所用的试剂或方法错误的是( )
选项 | 实验目的 | 所加物质或方法 |
A | 提纯硫酸钠中的硝酸钠 | 溶解、加适量的硝酸钡溶液,过滤, 洗涤,干燥 |
B | 除去氧化铜中的碳粉 | 在足量的空气中灼烧 |
C | 除去CO2中少量的HCl | 将混合气体通入饱和碳酸氢钠溶液、 再通入浓硫酸 |
D | 鉴别NaCl固体和NaOH固体 | 加水溶解 |
10. 某化学课外活动小组在准备实验时配制了Na2SO4、Na2CO3、BaCl2、HCl种溶液,因没及时贴标签,将其混淆。为将它们区别开来,把四种溶液编号为①②③④,并进行了下面的实验:
实验内容 | ①+② | ②+④ | ①+③ |
实验现象 | 白色沉淀生成 | 白色沉淀生成 | 有气泡冒出 |
按①②③④的顺序,由以上实验现象可以确定它们依次是 ( )
A. BaCl2、Na2CO3、Na2SO4、HCl B. HCl、Na2SO4、Na2CO3、BaCl2
C. Na2SO4、BaCl2、Na2CO3、HCl D. Na2CO3、BaCl2、HCl、Na2SO4
选择题答题卡:(请把正确选项填入下表内)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 |
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 34分)
二、填空与简答(共16分)
11.(4分)化学用语是学习化学的重要工具,是国际通用的化学语言。请用化学用语回答下列问题:
(1)铝在空气中生锈的产物的化学式 。
(2)草木灰和纯碱溶液中都存在的离子 。
(3)硝酸铵中氮元素的化合价 。
(4)通过化合反应生成水的化学方程式 。

![]() 12.(4分)氧化还原反应是自然界中一个非常重要的反应类型,对人们的生产、生活有着十分重要的作用。一般地说,凡是化学反应前后元素化合价有变化的反应一定是氧化还原反应,而且在一个氧化还原反应中,元素化合价升高的反应为氧化反应,化合价降低的反应为还原反应,氧化反应和还原反应同时发生,我们可以把初中阶段学过的四种基本类型的反应和氧化还原反应的关系归纳如右图:其 中Ⅰ为化合反应,则Ⅱ为 反应。写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。化学反应 C+H2O CO↑ + H2↑,属于图中的反应 (填Ⅰ、Ⅱ、Ⅲ、Ⅳ),其中水作为 剂。
12.(4分)氧化还原反应是自然界中一个非常重要的反应类型,对人们的生产、生活有着十分重要的作用。一般地说,凡是化学反应前后元素化合价有变化的反应一定是氧化还原反应,而且在一个氧化还原反应中,元素化合价升高的反应为氧化反应,化合价降低的反应为还原反应,氧化反应和还原反应同时发生,我们可以把初中阶段学过的四种基本类型的反应和氧化还原反应的关系归纳如右图:其 中Ⅰ为化合反应,则Ⅱ为 反应。写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。化学反应 C+H2O CO↑ + H2↑,属于图中的反应 (填Ⅰ、Ⅱ、Ⅲ、Ⅳ),其中水作为 剂。
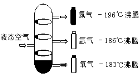
13. (3分) 如图A~D是四种粒子的结构示意图,E是铈元素在元素周期表中的信息:(多个答案的必须选全)
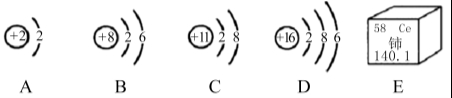
(1)在A~D中,位于同一周期的元素是 (填字母);
(2)在A~D中,具有相对稳定结构的粒子是 (填化学符号);
(3)铈的相对原子质量为 。
14.(4分)一包白色粉末,由NaOH、Na2SO4、CaCO3、CuCl2、BaCl2、NaCl中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到沉淀和无色滤液。
(2)取实验(1)滤出的沉淀,向其中加入足量的盐酸,沉淀全部溶解,产生无色气体,同时溶液变成蓝色。则原白色粉末中一定含有 。
根据上述实验可推断:原白色粉末的组成有 种可能。
为进一步探究原白色粉末的组成,取实验(1)得到的滤液,向其中通入二氧化碳,产生白色沉淀,则可推断原白色粉末的组成为 或 。
15. (1分)“科学认识”确保健康,生活中的下列做法,你认为合理的是 。
A.家居装饰好后可使用活性炭吸附一些有异味的物质
B.发霉的大米蒸熟后可放心食用
C.为防止骨质疏松,可以多吃奶类、豆制品、虾皮等食物
D.合格的火腿肠中含有防腐剂亚硝酸钠,因此也不能食用
E. 市售香烟通常装有过滤嘴,所以吸烟对人体无害
三、实验与探究(共12分)
 16.(7分)某实验小组同学用加热草酸晶体制得CO,并利用CO来完成炼铁实验,请你参与过程分析。
16.(7分)某实验小组同学用加热草酸晶体制得CO,并利用CO来完成炼铁实验,请你参与过程分析。
【查阅资料】
(1)实验室常用氢氧化钠溶液除去二氧化碳,用澄清石灰水检验二氧化碳。
(2)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:
![]() H2C2O4•3H2O CO2↑+CO↑+4H2O
H2C2O4•3H2O CO2↑+CO↑+4H2O
【问题讨论】
实验室提供下列仪器供选择使用:①试管 ②烧杯 ③集气瓶 ④蒸发皿 ⑤酒精灯⑥带导管的橡皮塞 ⑦铁架台(含铁夹) ,其中你认为在加热分解草酸晶体的装置中,需要用到的仪器有
(填序号)。
进入D装置的气体是纯净、干燥的CO,则A,C装置中的试剂依次是 、
(填名称);
(3)写出A装置中发生反应的化学方程式 ;
(4)B装置的作用是 ;
(5)证明草酸晶体分解产物中存在CO的现象是 ;
【实验评价】
反思:请指出上述实验装置的一个明显缺陷 。
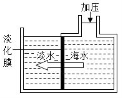
17.(5分)已知在某化肥K2SO4样品中可能混入了NH4Cl、NH4NO3、K2CO3三种物质中的一种或多种,为推测混入的物质种类,现按图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。
试根据实验过程和发生的现象填写以下空白:
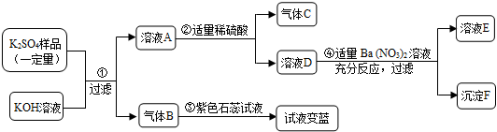
(1)常温下,气体B水溶液的pH 7(填“大于”“小于”“等于”之一)。
(2)实验步骤②的现象证明可能混入的三物质中,一定存在的物质是 。
(3)根据上述实验,已经证明了溶液E中存在的溶质有(写化学式) 。
(4)仅根据上述实验现象, NH4Cl、NH4NO3、K2CO3三种物质中,还不能确定是否混入化肥K2SO4样品中![]() 物质是 (写化学式)。
物质是 (写化学式)。
(5)要进一步推理化肥样品中的物质,可用溶液E再实验,请简要说明实验操作步骤、发生的现象及结论 ![]()
四、计算与应用(共6分)
18. (2分)荷叶茶具有清凉败火,消脂润肠等功效,因减肥效果明显,所以深受人们喜爱。荷叶碱(化学式为C19H21NO2)是荷叶中的一种生物碱,为荷叶中的主要降脂活性成分;请你计算:
(1)荷叶茶中氢元素与氧元素的质量之比是 ;
(2)荷叶茶中碳元素的质量分数是 (精确到0.1%)。

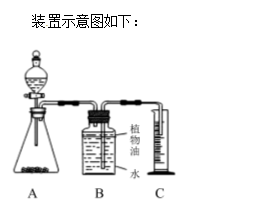
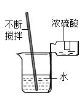
19. (4分)某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定。实验设计:
甲组:取纯净碳酸钙粉末5g于烧杯中,加入20g该盐酸溶液,充分反应后,过滤、洗涤、干燥,称量得剩余固体3g。
乙组:取纯![]() 净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,测定产生二氧化碳的体积0.4L(20℃、标准大气压,二氧化碳的密度为1.977g/L)计算盐酸浓度。
净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,测定产生二氧化碳的体积0.4L(20℃、标准大气压,二氧化碳的密度为1.977g/L)计算盐酸浓度。
【数据处理】:
(1)你认为哪一种实验方法不准确,请说明原因
。
(2)请利用你认为实验合理的一组数据计算该盐酸的溶质质量分数。(写出计算过程)
![]() 2018年济宁中考化学冲刺试卷参考答案
2018年济宁中考化学冲刺试卷参考答案
一、选择题(下列各题只有一个正确选项。其中,1-4小题各1分,5-10题各2分,本大题共16分。)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | C | D | D | C | C | D | A | B | A | D |
![]()
![]() 二、填空与简答(共16分)
二、填空与简答(共16分)
11.(1) Al2O3 (2) CO32- (3)NH4NO3 (4) 2H2+O2 2H2O
12. 分解反应;NaOH + HCl = H2O + NaCl(其它答案合理即可); Ⅳ; 氧化。
13. (1) CD (2) He、Na+ (3) 140.1
14. NaOH、CaCO3、CuCl2; 6 ; NaOH、CaCO3、CuCl2、BaCl2; NaOH、CaCO3、CuCl2、BaCl2、NaCl
15. AC
三、实验与探究(共12分)
16. (1) ①⑤⑥⑦
(2) 氢氧化钠 浓硫酸
(3) 2NaOH+CO2=Na2CO3 +H2O
(4)检验一氧化碳中是否含有二氧化碳
(5)D装置中的红色粉末慢慢变成黑色 【实验评价】没有尾气处理装置
17. (1)大于
(2)K2CO3
(3)KNO3
(4)NH4Cl、NH4NO3
(5)向溶液E中加入硝酸银,如果有白色沉淀生成,说明样品中含有NH4Cl,可能含有NH4NO3;如果没有白色沉淀,则样品中含有NH4NO3,不含有NH4Cl。
四、计算与应用(共6分)
17. (1)21:32 (1分) (2)77.3% (1分)
18.(1)乙组数据不准确,原因:测量的水的体积小于生成气体的体积; B、C之间的导管内实验前无水,实验后有水;内外气压相同时,二氧化碳无法将相应体积的水压入量筒;二氧化碳可能溶解在A中反应后的溶液中。(1分,合理答案均可给分)
(2)根据甲组数据计算
解:设参加反应的HCl质量为x ,消耗碳酸钙质量为5g-3g=2g
2HCl+CaCO3=CaCl2+H2O![]() +CO2↑ (1分)
+CO2↑ (1分)
73 100
x 2g
73/x=100/2g
x =1.46g (1分)
盐酸的溶质质量分数为:1.46g/20g×100%=7.3% (1分)
答:盐酸的溶质质量分数为7.3%。

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...