由于格式问题,部分试题会存在乱码的现象,请考生点击全屏查看!
化学试卷
可能用到的相对原子质量:
H—1 O—16 C—12 N—14 Mg—24 S—32 Mn—55 Fe—56
一、选择题(在每小题给出的四个选项中,只有一项符合题目要求,请选出并在答题卡上将该选项涂黑。每小题 2分,共 20分)
1.我们每时每刻都离不开空气。空气中含量最多的气体是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
2.蛋白质是成长期的青少年摄入量较大的营养素之一,下列食品中富含蛋白质的是
A.苹果 B.大米 C.豆腐 D.植物油
3.世界上的物质多种多样,下列物质属于氧化物的是
A.葡萄糖 B.液氧 C.氯酸钾 D.一氧化碳
4.在“配制 100克 5% 的氯化钠溶液”的实验中,下面操作正确的是

A B C D
5.镁是航空工业的重要材料,参考下图,下列说法正确的是
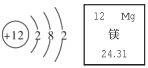
A.镁原子的核外有 3个电子层
B.镁原子的相对原子质量为 24.31g
C.保持镁化学性质的最小粒子是镁分子
D.在化学反应中,镁原子容易得到 2个电子
6.下列区分物质的方法正确的是
A.用水区分炭粉和二氧化锰 B.用灼烧法区分合成纤维和羊毛
C.用燃着的木条区分二氧化碳和氮气 D.用酚酞溶液区分氢氧化钠和碳酸钠
7.实验室用将氯酸钾与二氧化锰加热制取氧气。下列说法中正确的是
A.实验完毕,迅速取下试管,用水冲洗
B.完全反应后剩余的固体物质是纯净物
C.发生装置中所用的玻璃仪器有试管、导气管、酒精灯、长颈漏斗
D.充分反应后的剩余固体中获得二氧化锰的方法是:溶解、过滤、洗涤、干燥
8.化学兴趣小组的同学为探究分子的性质做了如图所示实验。下列说法中正确的是

A.浓氨水呈酸性
B.两团棉花都变红
C.氨分子是由氨原子构成的
D.氨分子不断运动到蘸有酚酞溶液的棉花上
9.试管中盛有 10℃时 KMnO4的不饱和溶液,参考下图,下列说法正确的是
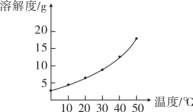
A.保持温度不变,向试管内加入一定量的 KMnO4固体,溶液中溶质质量分数一定增加
B.恒温蒸发溶液,试管中一定有晶体析出
C.将试管中的溶液升温,溶质的质量分数一定增大
D.将试管中的溶液降温,一定有溶质析出
10.下列实验符合右图所示变化趋势的是
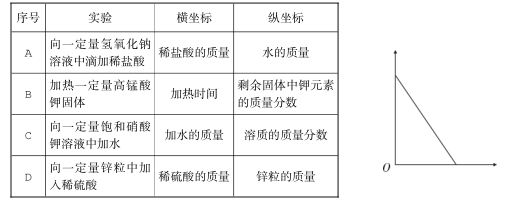
可能用到的相对原子质量:
H—1 O—16 C—12 N—14 Mg—24 S—32 Mn—55 Fe—56
二、生活生产应用题(化学方程式每空2分,其余每空1分,共 11分)
21.许多化学知识可以解决生活中的实际问题,请按要求填空。
(1)由于水质原因,水壶用久后,会沉积水垢,水垢的主要成分是碳酸钙和氢氧化镁,其
中碳酸钙的化学式为_____。写出用盐酸除去水垢的一个化学方程式____________。
(2)蒸馒头时,向发酵的面团内加入一定量的碳酸氢钠粉末,该物质能与面团中的___(填微粒符号)发生反应产生二氧化碳。
(3)要区分厨房中的食盐和纯碱,人们通常采用如下两种方法。
方法 1:如图 1所示,充分溶解后,可观察到_________,从而区分出二者。(查阅信息,20℃时,NaCl的溶解度为 36g,Na2CO3的溶解度为 21.5g)
方法 2:如图 2所示,分别向盛有两物质的试管内加入等质量的食醋,可观察到______,从而区分出二者。


图1 图2
22.锌锰干电池所含的汞、酸或碱等,废弃后对环境造成严重危害。某化学兴趣小组拟采
用如下处理方法回收废电池中的各种资源。

(1)操作 A 的名称为_______。
(2)加入 30% 的 H2O2溶液后,发生的反应为 Cu+H2O2+H2SO4=CuSO4+2H2O,反应中化合价升高的元素是________。
(3)上述溶液 X 中的溶质一定有_________。
(4)将锌筒放入溶液 X 中后,使溶液由蓝色变为无色的化学方程式为________。
三、物质组成分析题(化学方程式每空 2分,其余每空 1分,共 7分)
23.从古到今,人们对空气成分的研究一直都在进行。
(1)二百多年前,法国化学家拉瓦锡用图1所示装置,定量测定了空气中氧气的含量,他把少量的汞放在密闭容器中加热 12天,其目的是________________,其反应的化学方程式
为![]() ,则 X 的化学式为______。
,则 X 的化学式为______。
(2)目前,我们用图2所示装置来测定空气中氧气的含量,反应的化学方程式为_____,红磷燃烧的现象为_______,若操作不当,会产生实验误差,写出集气瓶内液面上升不足约 1/5的一个原因是___________________。


图1 图2
测定空气中氧气含量的装置还有很多,下图装置能达到实验目的的是______.

a b c
五、科普阅读理解题(每空 1分,共 6分)
24.溴化银(化学式为 AgBr)是一种感光材料,照相胶片上的溴化银在光的作用下,部分发生分解反应生成银原子,从而显示出黑色的影像。而大量未感光的溴化银还残留在胶片上,定影时,与定影液中的硫代硫酸钠(化学式为 Na2S2O3)反应,转化为可溶性的银离子。
大量可溶性的银离子会污染环境。用置换法或沉淀法,将废定影液中的银离子转化为银单质,可使其变废为宝。置换法是将锌等金属粉、金属块或金属条直接放入废定影液中,银便附着在金属表面。沉淀法是先加入硫化钠溶液使银离子转化为硫化银黑色沉淀,再加入热的浓盐酸和铁粉,便可得到银。
(1)硫代硫酸钠中硫元素的化合价为___,所含硫、氧元素的质量比为____。
(2)锌等金属加入废定影液中,可以析出银单质的原因是______,该反应的微观实质是:锌原子变为锌离子,___________________。
(3)定影液中银离子能与硫化钠溶液反应生成硫化银沉淀,该反应能发生的原因是_____。
(4)阅读上述短文,你一定收获了新的知识,下列说法中正确的是______。
a.溴化银见光易分解,使底片的颜色变深
b.AgBr可被 Na2S2 O3溶液反应而溶解
c.采用置换法制得银,用金属块会比金属粉、金属条反应速率快
六、活动探究题(化学方程式每空2分,其余每空1分,共 20分)
【实验原理分析】
25.化学研究小组用下图实验装置验证物质的某些性质并收集气体。

(1)写出下列仪器的名称:a ______
(2)组装仪器,检查气密性。关闭 K1,打开 K1,开始实验。写出 C 装置中反应的化学方程式_______。为收集干燥的氧气,在 B 装置中加入 银 ,A 装置验满氧气的方法为____。
(3)关闭 K1,打开 K2,一段时间后 D 中的现象为________,E 中发生反应的化学方程式为___________________________。
【物质性质探究】
26.学校科技节中某学生展示了如下化学魔术,请你解释这些现象。
在试管中加入硫酸铜溶液,向其中加入过量氢氧化钠溶液,反应完毕,接着向该试管中加入过量的稀盐酸。

(1)上图试管中发生反应的化学方程式为_______,加入过量稀硫酸后反应的现象是___。
(2)实验完成后溶液中的阳离子是____________。
27.某兴趣小组同学将 CO2通入氢氧化钠溶液中,无明显现象。为探究二者是否发生反应,同学们进行了以下的活动。
甲组活动:
【进行实验】

【质疑反思】
小组同学认为上述实验不严谨的理由为__________________。
【改进实验】
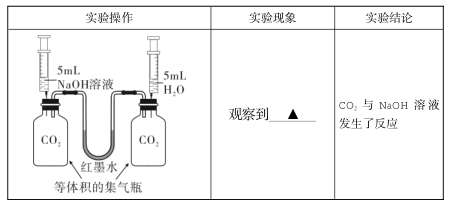
【拓展提升】
同学们认为上述装置还可以研究的问题是_______
A.比较氧气和二氧化碳在水中的溶解能力
B.比较氢氧化钠固体和硝酸铵固体溶于水后的热量变化
C.比较饱和氢氧化钠和氢氧化钙溶液吸收二氧化碳气体的能力
乙组活动:
同学们设计了如下图所示的方案,以验证反应的发生。
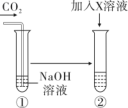
加入 X 溶液后观察到试管于中有明显现象,由此说明NaOH 与 CO2 发生了反应,则 X 的化学式为______________。
全班交流:
上述实验证明了 CO2与 NaOH 溶液能发生反应,反应的化学方程式为______,同时也得出验证无明显现象化学反应发生的设计思路是_________________________。
七、定量分析题(共 6分)
28.某钢铁厂用铁矿石炼铁。
(1)常见的铁矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、硫铁矿(FeS2),不选择硫铁矿炼铁
的原因是_________________________。
(2)若该厂购买 600吨含氧化铁 80% 的赤铁矿炼铁,最多可生产铁的质量是多少?

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...