![]() 2018阜阳中考化学模拟试题【精编Word版内附全部答案】
2018阜阳中考化学模拟试题【精编Word版内附全部答案】
由于格式问题,部分试题会存在乱码的现象,请考生点击全屏查看!
一、选择题(20分)
1. 中国的神舟飞船已经进入批量生产。神舟系列飞船采用火箭来发射,“长征”系列运载火箭在升空时发生的下列变化中属于化学变化的是( )
A.导流槽内的水受热汽化 B.火箭点火
2. 绿茶是安徽的特产,种类很多,绿茶是将新鲜的茶叶炒熬,破坏其中酵素再经搓揉、烘焙而![]() 成。茶叶的化学成分主要是茶碱(C8 H10 N4O2),还有鞣酸及芳香油等,下列说法错误的是( )
成。茶叶的化学成分主要是茶碱(C8 H10 N4O2),还有鞣酸及芳香油等,下列说法错误的是( )
A.茶碱由四种元素组成 B.一个茶碱分子中含24个原子
C.茶叶是混合物 D.茶碱中氧元素的质量分数最大
3. 规范实验操作是获得实验成功的重要保证。下列实验操作错误的是
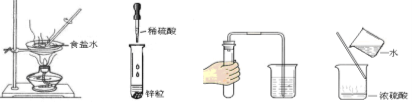
A.蒸发食盐水 B.滴管的使用 C.检查装置气密性 D.稀释浓硫酸
4. 安徽省科技活动周紧紧围绕“携手建设创新型安徽”这一主题,突出“科技与文化融合、科技与生活同行”这一主线并提出了“节约能源资源、保护生态环境、保障安全健康”的理念。以下说法不符合这一理念的是( )
A.组织学生到社区宣传节水节电小窍门 B.加大开采煤矿
C.夏天和冬天合理设置空调温度 D.拒绝使用一次性筷子和餐巾纸
5. 关于SO2、C02、Mn02三种物质,下列说法错误的是( )
A.都含有氧元素
B.都是化合物
C.都是氧化物
D.都含有氧分子
6. 对下列事故处理的方法错误的是( )
A.如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再徐上硼酸溶液
B.当酒精洒在桌面上并着火燃烧时,不要惊慌,应立刻用湿抹布扑盖
C.浓H2S04沾在皮肤上,立即用NaOH溶液处理
D.发现人员一氧化碳中毒时,立即转移到通风的地方救治
7. 将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是( )
A.CaCl2 HC1 NaNO3
B.KOH HC1 (NH4)2S04
C.K2CO3 Ba(NO3)2 NaOH
D.FeCl3 NaCl KNO3
8. 下表是某同学整理的实验报告,其中错误的是( )
选项 | 实验内容 | 加入试剂或方法 |
A | 鉴别(NH4)S02固体和K2S04固体 | 加熟石灰研磨 |
B | 鉴别羊毛纤维和涤纶 | 抽丝灼烧 |
C | 鉴别黄金和黄铜 | 观察颜色 |
D | 鉴别硬水和软水 | 加肥皂水 |
9. 如图所示,1与2是并列关系,3包含在2中,下列选项不符合这种关系的是( )
选项 | A | B | C | D |
1 | 饱和溶液 | 纯净物 | 单质 | 微量元素 |
2 | 不饱和溶液 | 混合物 | 化合物 | 常量元素 |
3 | 溶液 | 合金 | 酸 | 钙 |

10.如图为甲、乙两种固体物质在水中的溶解度曲线.下列说法错误的是( )
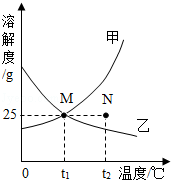
| A. | 甲物质的溶解度随温度的升高而增大 |
| B. | 在t1℃时,甲、乙两物质的溶解度相等 |
| C. | 在t2℃时,N点表示甲物质的不饱和溶液 |
| D. | 在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g |
二、填空题(34分)
11.在“熟石灰、食醋、焊锡、石墨、维生素C、聚四氟乙烯”中选择适当的物质填空:
(1)属于合金的是:_________ (2)可用于检验鸡蛋壳中含有碳酸盐的是_______
(3)常用作电极的是___________(4)可用于改良酸性土壤的是________________
(5)缺乏______会引起坏血病; (6)可用作不粘锅内衬的是__________________
12.下面是某化工厂生产烧碱的工业流程图。
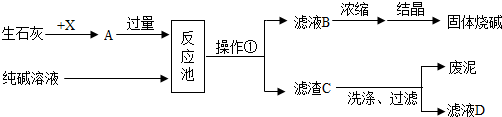
请根据以上信息回答下列问题:
(1)请写出X物质在实验室中的一种用途 。
(2)反应池中发生反应的化学方程式为 。
(3)操作①的名称是 ,结晶得到的固体烧碱中可能含有少量的
(写化学式)。
(4)滤液D可加入反应池循环再利用,目的是降低生产成本和防止 。
13.下图是实验室常用的实验仪器与装置,根据所学化学知识回答下列问题:
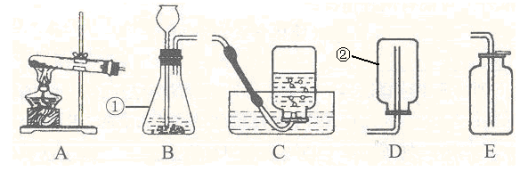
(1)写出标号的仪器名称:①_________,② 。
(2)用C或E装置都可收集O2,请说出用C装置收集的优点 。
(3)用E装置收集CO2时,检验CO2是否收集满的方法是__________ _______________。
(4)常温下,乙炔是一种无色气体,密度比空气略小,难溶于水。实验室常用碳化钙![]() 固体与饱和食盐水反应来制取乙炔。现选择合适的装置来制取并收集乙炔,应该选择的发生装置是_____(填序号,下同),收集装置是______。
固体与饱和食盐水反应来制取乙炔。现选择合适的装置来制取并收集乙炔,应该选择的发生装置是_____(填序号,下同),收集装置是______。
(5)SO![]() 2是一种无色、有刺激性气味的有毒气体,易溶于水,水溶液呈酸性,密度比空气大,常温下在空气中不反应。
2是一种无色、有刺激性气味的有毒气体,易溶于水,水溶液呈酸性,密度比空气大,常温下在空气中不反应。
若用排空气法收集SO2(如右图),为了避免SO2对环境的污染,收集装置的后面应串联一个尾气处理装置,请你把集气瓶内的导管补充完整(图中“→”表示气体流向),试管内盛放的溶液可以是 (填一种即可)。
14.小宏在探究金属性质的活动中发现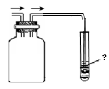 ,钠放入硫酸铜溶液中产生气泡,溶液中出现蓝色沉淀。
,钠放入硫酸铜溶液中产生气泡,溶液中出现蓝色沉淀。
【提出问题】为什么没有析出红色固体铜而是产生气体?
【查阅资料】钠的密度0.97g/cm3,熔点97.8℃;钾、钙、钠等活泼金属与水能剧烈反应产生氢气和对应的碱。写出钠与水反应的化学方程式:____________________________
____________________________________________。
【现象分析】上述出现蓝色沉淀现象的原因是_________________________________
__________________________________;蓝色沉淀的化学式为________________。
【设计实验】
(1)钠放入硫酸铜溶液中,观察现象。
(2)将钠放在盛有水的烧杯中,观察到________________________________现象。该实验目的是______________________________________。
【拓展与应用】
(3)将镁放入氯化铵溶液中加热,观察到的现象:溶液中产生大量气泡,并闻到有刺激性气味,该气体可能是______________。
【注意:若答对第(4)小题奖励4分,化学试卷总分不超过60分。】
(4)已知氯化铵溶液显酸性,第(3)小题中反应生成的气体中还含有的气体是________,验证该刺激性气味的气体的方法是_____________________________________________。写出第(3)小题中反应的化学方程式:_____________________________________________。
15.某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙,设计实验方案如下,请参与实验并回答问题。
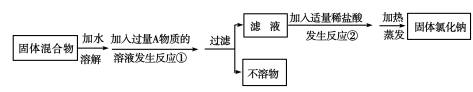
(1)写出A物质的化学式 ,写出A物质的俗称 。
(2)写出反应②的化学方程式 。
(3)反应①中加入过量A物质的目的是 。
反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度 (填“有”或“没有”)影响。
若正确回答第(4)小问,可获得4分的加分,但化学试卷不超过60分。
(4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果 (填“增大”、“不变”或“减小”),其原因是 ;你认为加入适量盐酸应依据的现象是 。
三.计算题(6分)
16.安徽某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。)有关实验数据如下表:
| 反应前 | 反应后 | |
实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
180 g | 12g | 187.6g | |
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为——g。
(2)求该石灰石中碳酸钙的质量分数。、
一、选择题
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | B | D | D | B | D | C | A | C | A | D |
11. (1)焊锡 (2)食醋 (3)石墨 (4)熟石灰 (5)维生素C (6)聚四氟乙烯
12.(1)洗涤仪器(或做溶剂或反应物或溶解物质等合理答案)
(2) Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (3)过滤 Ca(OH)2 (4) 环境污染
13.(1)锥形瓶 集气瓶 (2)收集的气体比较纯或不需要验满(3)将燃着的木条放在集气瓶口(4)B C(5)瓶内左侧导管延伸到瓶底 NaOH溶液(或Ca(OH)2溶液或H2O等)
【现象分析】钠和水反应生成氢氧化钠,氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜 Cu(OH)2
【设计实验】(2)钠熔化,浮在水面上 对比实验,探究产生气体的反应物
【拓展与应用】(3)氨气
(4)氢气 把湿润的紫色石蕊试纸放在容器口处,紫色石蕊试纸变蓝色,说明气体是氨气
Mg+2NH4Cl===MgCl2+2NH3↑+H2↑
15.(1)Na2CO3 纯碱 (2)Na2CO3+2HCl===2NaCl+H2O+CO2↑(3)使氯化钙完全反应(合理即可) 没有 (4)增大 加入过量的碳酸钠与盐酸反应也生成氯化钠 滤液中无气泡产生。
三.计算题
16.解:由质量守恒定律可得:二氧化碳的质量为192-187.6=4.4g
设石灰石中碳酸钙的质量为x
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
100 44
x 4.4g
100/x == 44/4.4g x=10g
10/12×100%=83.3%
答:略

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...