2018年吉林中考化学模拟压轴试题【精编word版含答案】
为了方便您的阅读请点击全屏查看
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Mg—24 Cl—35.5 K—39 Ag—108
一、选择题(本题包括10小题,每小题1分,共10分)
1.医疗上常用空气中含量最多的气体制成冷冻麻醉剂,该气体是 ( )
A.氮气 B.氧气 C.稀有气体 D.二氧化碳
2.下列各组物质中,均属纯净物的是( )
A.合成纤维 油脂 B.天然气 水银 C.冰水 干冰 D.医用酒精 碘盐
3.下列图示的实验中涉及到化学 变化的是( )
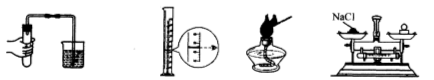
A.检查装置的气密性 B.读取水的体积 C. 点燃酒精灯 D. 称量氯化钠的质量
4 .下列说法正确的是 ( )
A. 金属表面涂油漆以防锈蚀 B.合金、塑料、合成纤维都属于合成材料
C.NH4NO3和熟石灰混合施用 D.“白色污染”是指白色物质引起的污染
5.草莓、香蕉等水果具有芳香气味,是因为其中含有乙酸乙酯(化学式为C4H8O2)等物质。下列关于乙酸乙酯的说法正确的是( )
A.该物质是由4个碳元素 、8个氢元素和2个氧元素组成的
B.1个乙酸乙酯分子中含有4个水分子
C.乙酸乙酯中碳、氢、氧的质量比为4:8:2
D.乙酸乙酯燃烧有二氧化碳和水生成
6.下列有关农药和化肥的叙述中不正确的是
A.施用农药是重要的作物保护手段B.为![]() 了减少污染应按规定合理施用农药
了减少污染应按规定合理施用农药
C.铵态氮肥不能与碱性物质混合施用D.化肥能增产,所以可长期施用硫酸铵
7.二氧化碳和氢气可在一定条件下反应,生成一种重要的化工原料甲醇:
![]()
CO2+3H2 CH3OH+H2O。下列有关该反应的说法正确的是( )
A.为CO2的利用创造了一种新途径 B.钌-膦铬合物的质量在反应前后发生了变化
C.氢原子数在反应前后发生了改变 D.属于复分解反应
8.除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
选项 | 物质 | 杂质 | 除杂试剂及操作方法 |
A | 二氧化碳 | 一氧化碳 | 通入氧气,点燃 |
B | 氢气 | 氯化氢 | 先通过过量氢氧化钠溶液,再通过过量浓硫酸 |
C | 锌粉 | 铁粉 | 加入适量氯化锌溶液,充分反应后过滤 |
D | 氯化钾溶液 | 碳酸钾 | 加入过量氯化钙溶液,充分反应后过滤 |
9.(2017枣庄)2017年5月18日,我国首次在南海神狐海域试采“可燃冰””(天然气水合物)成功,下列关于“可燃冰”说法正确的是( )
A.“可燃冰”外形像冰,是天然气冷却后得到的固体
B.“可燃冰”燃烧后几乎不产生残渣和废气,被誉为“绿色能源”
C.通常状况下,天然气和水就能结合成“可燃冰”
D.“可燃冰”储量巨大,属于可再生能源
10.某K2CO3样品,可能含有Na2CO3、MgCO3、NaCl中的几种杂质.取该样品6.9g,加入50g稀盐酸中,恰好完全反应得到无色溶液,同时产生2.2g气体.下列判断正确的是( )
A.样品中一定没有 MgCO3 B NaCl不与盐酸反应,说明样品中一定没有NaCl
C.所加稀盐酸中溶质的质量分数为7.3%
D.Na2CO3和MgCO3都能和稀盐酸反应生成气体,说明样品中一定有Na2CO3和MgCO3
二、填空题(本题共8分)
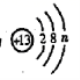
11.某原子的结构示意图为
它的最外层电子数n=___________,核外共有_____________个电子。
12.(生活离不开水。净化水的知识在日常生活中有着广泛的应用。
(1)茶杯内的纱网,可将茶叶与茶水分离,便于饮用,该设计利用的化学原理是________。
(2)自制净水器中常加入________,用于除去水中的异味和色素。
(3)自来水厂用二氧化氯消毒杀菌,二氧化氯的化学式为________。
(4)井水中含有较多的钙、镁离子,为降低硬度,可采用的方法是________。
13.(3分)化学与生产、生活密切相关。
(1)配制农药波尔多液所用硫酸铜的构成粒子是________(填化学符号)
(2)酒精燃烧的化学方程式为![]() ________________________ 。
________________________ 。
(3)氯碱工业中电解食盐水得到烧碱和两种气体,一种是最轻的气体,另一种的相对分子质量为71。该反应的化学方程式 ________________________________ 。
(4)硬水中含较多的Ca2+、Mg2+,常用________________区分硬水和软水;“84”消毒液的有效成分NaClO中氯元素的化合价为 ________;Cl2常作自来水消毒剂,其实验室制法为:MnO2+4HCl(浓) △ X+Cl2↑+2H2O,X的化学式为________________。
三.简答题(16分)
14.(3分)能源和环境问题日益成为人们关注的焦点。
(1)常见的化石燃料有煤、______和天然气等。天然气(主要成分是CH4)在空气中完全燃烧的化学方程式是 ________________________。
(2)燃煤会影响环境。下列环境![]() 问题与燃煤没有直接关系的是______(填序号,下同)。
问题与燃煤没有直接关系的是______(填序号,下同)。
A.酸雨 B.温室效应 C.臭氧层破坏 D.可吸入颗粒物增加
 (3)CO2含量不断升高,使全球气候问题日趋严重。下图为CO2参与的一种“碳转化”。
(3)CO2含量不断升高,使全球气候问题日趋严重。下图为CO2参与的一种“碳转化”。
![]()
![]()
![]()
![]()
①下列物质中,属于![]() 有机物的是______。
有机物的是______。
A.CaCO3 B.C2H5OH C.CO
 ②CO2和H2在催化剂和加热条件下,可以转化为化工原料乙烯(C2H4),请将该
②CO2和H2在催化剂和加热条件下,可以转化为化工原料乙烯(C2H4),请将该![]() 反
反
应的化学方程式补充完整:2CO2+ 6H2 C2H4+ 4______。
③将CO2通入Na2CO3溶液中,只生成NaHCO3,该反应的化学方程式是________。
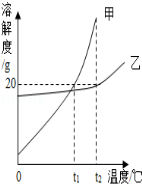
15.(4分)如图是甲、乙两种固体物质的溶解度曲线.
(1)由图中可看出,甲乙两物质中,溶解度受温度影响较大的物质是 ________;
(2)要使甲的饱和溶液变为不饱和溶液,可采取的方法是________ (写出一种即可);
(3)t2℃时,将甲、乙各20g分别加入到两只盛有100g水的烧杯中,充分搅拌,所得乙溶液为________溶液(填“饱和”或“不饱和”);若将温度都降低到t1℃,甲溶液中溶质的质量分数________(填“>”、“<”或“=”)乙溶液中溶质的质量分数.
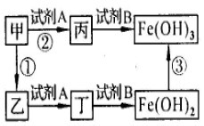
16.(4分)右图中,甲时氧化物,其中金属元素质量分数为70%;乙是黑色粉末;丙和丁是可溶性盐。反应①和②的化学方程式分别为________________ 、________________ ;![]()
试剂B是________ (填化学式)溶液; 反应③的发生需要氧气和水,其化学方程式________________________ 。
四、实验题(本题包括2个小题,共10分)
17. 为了研究CO2的性质,需要制取并收集干燥的CO2气体。以下是老师提供的一些实验装置。
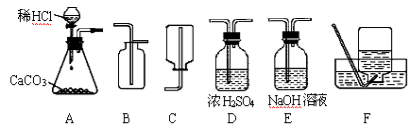
(1)制取并收集干燥的
CO2气体,可采用的
装置组合是________
(填字母)。
(2)实验室制取
CO2的化学方程式为 ________________________ 。
(3)若在上述实验中气体无法收集满,则可能的原因是________________ 。
18. 2014年4月松原市发生4.8级地震,灾区饮用水与食品安全备受关注。
(1)水中难闻的异味,可添加活性炭除去,这是利用了活性炭的 ________ 性。
(2)初步净化后的水,可以通过________方法,降低水的硬度。
(3)“84消毒液”可用于灾区防疫。制备其主要成分次氯酸钠(NaClO)的化学方程式为:2NaOH+X=NaC1O+NaCl+H2O,则X的化学式为________, NaClO中Cl的化合价为________。
(4)救援工作人员带去的包装食品中,有一些是用铁粉做双吸剂,铁粉既可以防腐又可以保持食品干燥,是因为铁粉能吸收空气中的________和 ________。
19.(2017贵港)某化学兴趣小组学习碱的性质后,到实验室做实验。小明将二氧化碳通入氢氧化钠溶液后无明显现象,然后向得到的溶液中滴加CaCl2溶液,产生白色沉淀;小杰做的实验和小明一样,但没有出现白色沉淀。他们为了查明原因,查阅资料:① CO2与NaOH反应的产物与反应物的量有关,少量CO2得到Na2CO3,过量CO2得到NaHCO3,反应的化学方程式:CO2+2NaOH = Na2CO3+H2O, Na2CO3+CO2+H2O=2NaHCO3;② Ca(HCO3)2溶于水,溶液呈碱性;③ CaCl2溶液呈中性:④ Na2CO3、NaHCO3溶液都呈碱性,都能与酸反应;⑤ 铝、锌、铁、铜的盐溶液与NaHCO3溶液混合会产生沉淀。
他们对CO2与NaOH溶液反应后,溶液中溶质是什么进行探究。
【猜想与假设】猜想①Na2CO3;猜想②NaHCO3;猜想③Na2CO3、NaOH;猜想④______。
【实验探究】
实验操作 | 实验现象 | 结论 |
(1)取适量反应后的溶液于试管中,加入适量的CaCl2溶液,振荡;再加入______ | 无明显现象;有气泡产生。 | 猜想②成立,反应的化学方程式__________。 |
(2)取适量反应后的溶液于试管中,加入过量的CaCl2溶液,振荡;过滤,取滤液于另一支试管中,滴加______。 | 产生白色沉淀;________。 | 猜想③成立 |
【继续探究】将4.0gNaOH固体溶解在100mL水中,然后通入4.0g二氧化碳气体,充分反应后,所得溶液的溶质是__________。
五、计算题(本题包括1小题,共6分)
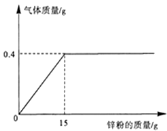
20. 向l33.4克稀盐酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如下图所示。求:
(1)此过程产生气体的最大质量是______________;
(2)原稀盐酸中溶质的质量分数为多少?(诗写出计算过程)
2018年吉林中考化学模拟压轴试题参考答案
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | D | C | C | A | D | A | A | B | B | C |
二、填空题(本题包括4小题,共14分)
11. 3 13
12. (1)过滤 (2)活性炭 (3)ClO2 (4)加热煮沸(或蒸馏)
![]() 13..(3分)(1)Cu2+、SO42- (2)C2H5OH+ 3O2
13..(3分)(1)Cu2+、SO42- (2)C2H5OH+ 3O2 ![]() 2CO2 + 3H2O
2CO2 + 3H2O
(3)2NaCl+2H2O = H2↑+Cl2↑+2 NaOH(4)肥皂水; +1; MnCl2
![]() 14.(3分)
14.(3分)
(1)石油 CH4 + 2O2 CO2 + 2H2O (2)C
(3)①B ②H2O ③CO2 + Na2CO3 + H2O=2NaHCO3
15.(4分)
(1) 甲 (2) 升高温度 (3) 饱和 =
16. (4分) Fe2O3 +3CO 高温2Fe +3CO2 (或 2Fe2O3 +3C ![]() 高温 4Fe +3CO2 ↑等)
高温 4Fe +3CO2 ↑等)
Fe2O3 +6HCl = 2FeCl3 +3H2O[或 Fe2O3 +3H2SO4 = Fe2(SO4)3 +3H2O 等]
NaOH[或 Ca(OH)2 等;[ 4Fe(OH)2+O2 +2H2O = 4Fe(OH)3
三、实验题(本题包括2小题,共10分)
17. (4分)(1)ABCD CaCO3+2HCl=CaCl2+H2O+CO2↑ (2) c→d→a→b (3) 向下
18. ________.吸附 41. 煮沸(或蒸馏) 42. Cl2 43. +1
44. O2或H20(氧气或水) 45. H2O或O2(水或氧气)
19. 【答案】④NaOH。
【实验探究】
实验操作 | 实验现象 | 结论 |
(1)稀盐酸 |
| NaHCO3 + HCl ==NaCl + H2O + CO2↑。 |
(2)酚酞试液。 | 溶液变成红色。 |
|
【继续探究】碳酸钠和碳酸氢钠。
【解析】根据化学方程式2NaOH + CO2 ==Na2CO3 + H2O计算,4.0gNaOH可吸收2.2g二氧化碳气体,说明二氧化碳气体过量,有碳酸钠生成
16.(6分)( 1)NaCl (2)这二者的化学式中Na元素的右下角不会有2
(3)Na2CO3 BaCl2 + Na2CO3 = BaCO3↓+2NaCl ;
(4)取少量无色溶液样品于试管中,慢慢滴加稀盐酸。
在玻璃片上放一小片pH 试纸,将样品液滴到试纸上,把试纸显示的颜色与标准比色卡
比较,测得溶液pH 大于7。(或取少量无色溶液样品于试管中,滴加几滴无色酚酞,观察
到溶液变红等。)
计算题(本题包括1小题,共6分)
20.【答案】(1)0.4 (2)10.9%

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...