2018年深圳中考化学模拟试题【精编版含答案】
由于格式问题,部分试题会存在乱码的现象,请考生点击全屏查看!
说明:1.答题前,请将姓名、考生号用规定的笔写在答题卡指定的位置上。
2.全卷分化学部分、物理部分。化学部分40分,物理部分60分;考试时间90分钟,满分100分。
3.考生必须在答题卡上规定区域作答,否则其答案一律无效,答题卡必须保持清洁,不能折叠。
4.可能用到的相对原子质量:Mg-24 Cu-64 S-32 O-16 C-12 H-1 N-14
化学部分
选择题(本部分10小题,每小题1.5分,共15分。每小题只有一个选项符合题意)
下列各组的两种变化,都属于化学变化的一组是( )
煤气燃烧 冰块融化 B.茶杯破碎 剩饭变馊
C.菜刀生锈 水果腐烂 D.灯泡发光 人工降雨
2.下列基本实验操作的图标正确的是( )


下列说法正确的是( )
碳酸钠俗称纯碱,其溶液能使无色酚酞变红,所以碳酸钠属于碱
B.CH4 中碳元素的合化价为+4价
C.青蒿素(化学式C15H22O2)属于有机物
D.海鲜中添加剂“阿斯巴甜”(化学式C9H11NO2)中C、H、N、O四种元素的质量比9:11:1:2
下列说法正确的是( )
亚铁离子:Fe3- B.硅的原子序数是28 
![]()
C.镁原子结构示意图: D.三个氮分子:3N2
下面是某同学进行化学性质实验时记录的实验现象,其中与事实不相符的是( )
A.把铜片插入硝酸银溶液中,一段时间后取出,铜片表面有一层银白色物资
B.在Na0H溶液中加入CuS04溶液,有蓝色絮状沉淀生成
C.细铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.氯气在空气中燃烧时,产生淡蓝色火焰
![]()
![]() 6.某反应的微观示意图,其中 和 表示不同元素的原子。下列说法正确的是( )
6.某反应的微观示意图,其中 和 表示不同元素的原子。下列说法正确的是( )
反应前后原子数目发生改变
反应前后分子种类没有改变 ![]()
该反应属于化合反应
参加反应的两种分子个数比为1:2
下列图像分别与选项中的操作相对应,其中合理的是( )
向一定量稀硫酸中滴入水 B.向一定量纯碱和烧碱的混合溶液中滴入盐酸
C.一定温度时向一定量饱和石灰水中加入氧化钠 D.向一定量二氧化镭中加入过氧化氢溶液
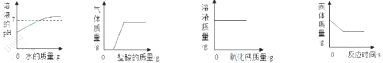
A B C D
下列有关溶液说法,正确的是( )
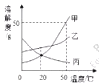
A.20℃时,甲、丙溶液的质量分数一定相等
B.50℃时,甲的饱和溶液的质量分数是33.3%
C.50℃时,把30g甲放入50g水中能形成80g甲的饱和溶液
D.只能采用冷却热饱和溶液法获得甲晶体
9.除去下列物资中的少量杂质,所选用试剂及操作方法均正确的是( )
选项 | 物质(括号内为杂质) | 选用试剂 | 操作方法 |
A | C02(CO) | 过量O2 | 点燃 |
B | Ca0(CaC03) | 足量蒸馏水 | 过滤、蒸发 |
C | Na Cl溶液(MgS04)溶液 | 适量BaCl2 | 过滤 |
D | FeCl2溶液(CuCl2溶液) | 足量铁粉 | 过滤 |
下列对部分化学知识的归纳完全正确的一组是( )
A.化学与生活 B.化学与环境
①生活中常用加热煮沸的方法软化硬水 ①焚烧植物秸秆不会造成空气污染
②用燃烧的方法区分羊毛和涤纶 ②PM2.5是造成雾霾天气的元凶之一
③干冰用于人工降雨 ③含磷洗涤剂的使用会导致水污染
C.化学与安全 D.化学与健康
①烧菜油锅着火可以用锅盖该灭 ①人体缺铁会引起贫血
②在室内放一盆水,可防止煤气中毒 ②用甲醛的水溶液浸泡海产品保鲜
③夜间发现液化气泄漏开灯寻找泄露源 ③食用蔬菜和水果来补充维生素
非选择题(11-13)共计25分,请将答案写在答题卡相应位置上。
(8分,其中化学方程式1.5分,其余每空1分)
A~1是初中化学常见的物质,他们之间的相互关系如下图所示。(“→”指向生成物。)其中B是红棕色粉末,A、C常温下是气体,H和I中含有一种相同元素,H不溶于稀硝酸,I是红竭色固体。请回答下面问题:
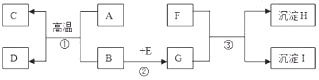
H的化学式是________,A在反应①中是利用其化学性物质中的______性
反应③的基本反应类型是_______________
物质F属于_________________(填“酸”、“碱”、“盐”或“氧化物”)
反应①的化学方程式为_______________
观察到的实验现象为______________________
实验室检验气体C的化学方程式:__________________________
(10分,其中化学方程式1.5分)化学实验时进行科学探究的重要方式,下面有两个化学实验。
 实验I 已知:二氧化碳气体既不溶于饱和NaHC03溶液也不与NaHC03反应:某学生欲用浓盐酸与大理石反应取干燥纯净的二氧化碳气体,实验时提供了下列装置和药品,请回答相关问题:
实验I 已知:二氧化碳气体既不溶于饱和NaHC03溶液也不与NaHC03反应:某学生欲用浓盐酸与大理石反应取干燥纯净的二氧化碳气体,实验时提供了下列装置和药品,请回答相关问题:
仪器①的名称是______________________
实验时制取二氧化碳气体的反应原理是_____________________(用化学方程式表示)
要制取干燥纯净的二氧化碳气体,实验仪器链接顺序应为A→______→_______→E
装置E收集二氧化碳气体,则气体应从________(填接口序号)进入
实验II 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。
请你与他们一起完成以下探究活动:
[对固体猜想]猜想I:全都是Na0H:猜想II:全都是NA2CO3;猜想III:是Na0H和Na2C02混合物
[实验和推断]

若A是盐酸,现象a为有气泡产生,说明氢氧化钠已经变质。
若A是Ca(0H)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,该实验_________(填“能”或“不能”)说明样品中有Na0H。
若A是CaCl2溶液,当实验现象a为_____________。现象b为_________。则猜想II成立。
[反思]久置的氢氧化钠变质的原因是(用化学方程式表示_________________________
(7分)取Cu-Mg合金30g放入烧杯,将100g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下,请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 25 | 25 | 25 | 25 |
剩余固体质量/g | 28.8 | 27.6 | 26.4 | 25.4 |
合金中Cu的质量是_______________________.
请用实验第1次的数据,计算所加稀硫酸的溶质的质量分数。(写出计算过程,计算结果精确到0.1%)
2018年深圳中考化学模拟试题选择题参考答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C | B | C | D | C | C | B | B | D | A |
非选择题
(1)BaS04 还原 (2)复分解反应 (3)碱
(4)3C0+Fe203=2Fe+3C02 红棕色固体变为黑色
(5)C02+Ca(0H)2高温CaC03↓+H20
实验I(1)长颈漏 (2)CaC03+2HCl=CaCl2+C02↑+H20
(3)D C (4)e
实验II (2)不能 (3)出现白色沉淀 溶液不变色
(3)C02+2Na0H=Na2C03+H20
(1)25.4g
(2)设硫酸的质量为X,参加反应的镁的质量为:30-28.8-12g
H2S04+Mg=MgS04+H2↑
98 24
X 1.2g
![]() x=4.9g
x=4.9g
硫酸的质量分数为:![]()
答:略

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...