由于格式问题此试题可能会出现乱码的情况
为了方便您阅读请点击右上角的全屏查看
2018眉山市中考化学压轴试题
一、选择题
1.下列化学反应属于置换反应的是( )
A.CO+CuO![]() Cu+CO2 B.Cl2+H2O=HCl+HClO
Cu+CO2 B.Cl2+H2O=HCl+HClO
C.Na2O+HCl=2NaCl+H2O D.C+H2O![]() H2+CO
H2+CO
2.下列做法可以达到预期目的是( )
A.用氖气作焊接金属的保护气
B.加入净水剂(如明矾),使硬水转化成纯净水
C.寻找新的催化剂使水变成油
D.做测定空气中氧气含量的实验时,用蜡烛代替红磷
3.硝化甘油(C3H5N3O9)可用于治疗心绞痛,因为它在人体内被缓慢氧化生成A气体:4C3H5N3O9+5O2═12A+12CO2+10H2O,则A的化学式为( )
A.NO B.NO2 C.N2 D.N2O
4.下列化常用语中,正确的是( )
A.两个氧分子﹣O2
B.氢氧化铁的化学式﹣Fe(OH)3
C.CO2中氧元素的化合价为+2价
D.水通电得到氧气的化学方程式是2H2O=O2↑+2H2↑
5(眉山市中考化学).实验室用草酸(H2C2O4)制取CO的化学方程式为H2C2O4![]() CO↑+X+CO2↑其中X的化学式为( )
CO↑+X+CO2↑其中X的化学式为( )
A.H2O2 B.H2O C.CH4 D.H2
6.某有机物R在足量氧气中完全燃烧后的化学方程式如下:2R+13O2![]() 8CO2+10H2O.根据质量守定律,R的化学式为( )
8CO2+10H2O.根据质量守定律,R的化学式为( )
A.C4H10 B.CH4 C.CH4O D.C2H4O2
7.如图是用来表示物质间发生化学变化的模型示意图,图中“![]() ”、“
”、“![]() ”分别表示两种不同元素的原子.能用该示意图表示的反应是( )
”分别表示两种不同元素的原子.能用该示意图表示的反应是( )
![]()
A.2H2+O2![]() 2H2O B.2H2O
2H2O B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2CO+O2![]() 2CO2 D.H2+Cl2
2CO2 D.H2+Cl2![]() 2HCl
2HCl
8.小明从化学方程式4P+5O2![]() 2P2O5中总结的信息有:①参加反应的物质是磷和氧气②反应条件是点燃③反应前后分子的总数不变④反应前后元素的种类不变.其中正确的是( )
2P2O5中总结的信息有:①参加反应的物质是磷和氧气②反应条件是点燃③反应前后分子的总数不变④反应前后元素的种类不变.其中正确的是( )
A.①②③ B.①②④ C.①③④ D.②③④
9.在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | X | Y | Z | Q |
反应前质量/g | 8 | 2 | 40 | 5 |
反应后质量/g | 待测 | 24 | 8 | 23 |
下列说法正确的是( )
A.该反应一定是置换反应
B.Y、Q的相对分子质量比一定为11:9
C.参加反应的X、Z的质量比为1:4
D.反应后X的质量为16
10.“绿色奥运”是2008年北京奥运会的主题之一.为减轻大气污染,在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体.试推测,该无毒混合气体是( )
A.N2和CO2 B.C02和N02 C.C02和O2 D.CO2和SO2
11.(眉山市中考化学)某化合物X在一定条件下有如下反应:X+6O2![]() 6CO2+6H2O.下列说法正确的( )
6CO2+6H2O.下列说法正确的( )
A.X由碳、氢两种元素组成
B.X中碳、氢两种元素的质量比为1:2
C.X的相对分子质量是174
D.X中碳元素的质量分数为40%
12.亚硝酸钠(NaNO2)外观与食盐很相似,有咸味,误食易中毒.区别它们的一种方法是:隔绝空气加热.没有明显变化的是食盐.能分解放出有刺激性气味气体的是亚硝酸钠.此气体可能是( )
A.SO2 B.NO2 C.N2 D.NH3
13.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质质量如下表,则该密闭容器中发生的化学反应类型为( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 4 | 2 | 58 | 5 |
反应后质量/g | 待测 | 27 | 0 | 19 |
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
14.下列观点中正确的是( )
A.通过化学变化可以改变原子的种类和个数
B.改变物质的性质一定要通过化学变化
C.在化学变化中原子中的电子数不会发生变化
D.在化学变化中都伴随着能量的变化
二、填空
15.(2分)为了将汽油发动机尾气中的NO转化为N2,在某催化剂作用下用NH3与NO反应,其化学方程式为:4NH3+6NO![]() 5N2+6H2O;在通常状况下,依据左式前后顺序,反应物与生成物中气体的化学计量数之比= .
5N2+6H2O;在通常状况下,依据左式前后顺序,反应物与生成物中气体的化学计量数之比= .
16.(9分)完成下列反应的化学方程式,在括号内注明反应类型(选填“化合”、“分解”、“置换”
或“复分解”)或回答问题.
(1)实验室加热高锰酸钾制氧气的反应: 、 .
(2)实验室用锌粒和稀硫酸制氢气的反应: 、 .
(3)生石灰与水生成熟石灰的反应: ;此反应过程中 (选填“吸热”或“放出”)热量.
(4)用澄清石灰水检验二氧化碳的反应: ;
问:为何一般可用澄清石灰水检验少量二氧化碳,却用氢氧化钠溶液吸收较多二氧化碳?
答: .
17.对知识的比较和归纳是学习科学的重要方法之一.现有以下3个反应的化学方程式:
①CuSO4+Fe=Cu+FeSO4
②CuO+H2![]() Cu+H2O
Cu+H2O
③SiO2+2C![]() Si+2CO↑
Si+2CO↑
(1)比较反应物和生成物的特点,可归纳出这3个反应的基本反应类型都属于 .
(2)从反应条件角度分析,这3个反应应用于生产最早的是(填编号) .
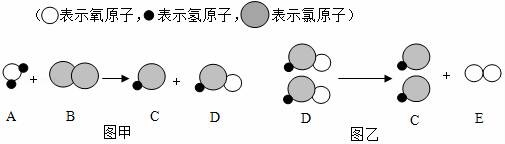
18.自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用如图表示:
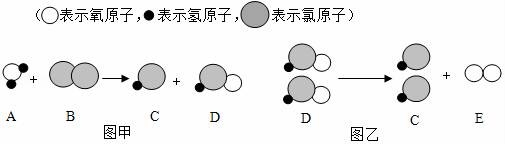
(1)图乙所示反应的基本反应类型为 反应;
(2)D物质中氯元素的化合价为 ;
(3)写出图甲所示反应的化学方程式 .
四、计算题
19.工业上用电解氯化镁方法生产金属镁:MgCl2![]() Mg+Cl2↑.现电解950Kg氯化镁最多能生产多千克单质镁?同时能得到多少千克氯气?
Mg+Cl2↑.现电解950Kg氯化镁最多能生产多千克单质镁?同时能得到多少千克氯气?
眉山市中考化学参考答案与试题解析
一、选择题
1.下列化学反应属于置换反应的是( )
A.CO+CuO![]() Cu+CO2 B.Cl2+H2O=HCl+HClO
Cu+CO2 B.Cl2+H2O=HCl+HClO
C.Na2O+HCl=2NaCl+H2O D.C+H2O![]() H2+CO
H2+CO
【考点】置换反应及其应用.
【分析】一种单质与一种化合物发生反应生成另一种单质和另一种化合物的反应是置换反应,其特征可表示为:A+BC=B+AC.
单质,由同种元素组成的纯净物;化合物,由不同种元素组成的纯净物.
【解答】解:A、CO、CuO均为两种元素组成的化合物,反应物中无单质,不符合置换反应的定义.故不选.
B、生成物HCl、HClO均为化合物,生成物中无单质,不符合置换反应的定义.故不选.
C、反应物Na2O、HCl均为化合物,生成物NaCl、H2O也全是化合物,反应中无单质,不符合置换反应的定义.故不选.
D、反应物中C只含C元素,为单质,H2O为化合物;生成物中H2为单质,CO为化合物,符合置换反应的定义.故选.
故选D
【点评】明确物质的分类,抓住概念的内涵,对选项进行分析.
2.(眉山市中考化学)下列做法可以达到预期目的是( )
A.用氖气作焊接金属的保护气
B.加入净水剂(如明矾),使硬水转化成纯净水
C.寻找新的催化剂使水变成油
D.做测定空气中氧气含量的实验时,用蜡烛代替红磷
【考点】常见气体的用途;测定空气里氧气含量的探究;硬水与软水;质量守恒定律及其应用.
【分析】A、根据氖气的化学性质不活泼判断.
B、根据明矾的净水原理,以及硬水的含义判断.
C、根据质量守恒定律判断.
D、根据蜡烛燃烧的产物判断.
【解答】解:A、氖气的化学性质不活泼,不和金属反应,且可隔绝氧气,防止金属氧化,所以正确.
B、硬水是含有较多可溶的钙、镁化合物的水,明矾溶解于水形成胶状物,能吸附水中不溶的杂质沉降下来,不能吸附可溶的钙、镁化合物,不能把硬水变成纯净的水,所以错误.
C、根据质量守恒定律,反应前后元素的种类不变,水是由氢、氧两种元素组成,油中含有碳元素,水永远不会变成油,所以错误.
D、做测定空气中氧气含量的实验时,选择的药品应是只能与氧气反应,且反应不生成新气体,但是蜡烛燃烧生成二氧化碳气体,所以错误.
故选A.
【点评】化学来源于生产、生活,也服务于生产、生活,因此与生产、生活相关的化学知识也是考查重点,特别是关于食品安全、营养与健康、能源、材料、环境保护、中毒解毒知识、燃烧与灭火等内容.
3.硝化甘油(C3H5N3O9)可用于治疗心绞痛,因为它在人体内被缓慢氧化生成A气体:4C3H5N3O9+5O2═12A+12CO2+10H2O,则A的化学式为( )
A.NO B.NO2 C.N2 D.N2O
【考点】质量守恒定律及其应用;有关化学式的计算和推断.
【分析】解此题需根据质量守恒定律,反应前后原子种类和个数都不变,分别统计出反应前后原子种类及个数,比较分析就可以求出所求的物质的化学式.
【解答】解:根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知反应物中含有的原子种类及原子个数为C,12;H,20;N,12;O,46;已知生成物中含有的原子种类及原子个数为C,12;H,20;O,34;比较分析可知12A中含有12个氮原子和12个氧原子,故A的化学式为NO.
故选A.
【点评】此题主要考查学生对质量守恒定律的实际运用,只有掌握了这一知识的内涵,才能自由驾御,正确解答.
4.下列化常用语中,正确的是( )
A.两个氧分子﹣O2
B.氢氧化铁的化学式﹣Fe(OH)3
C.CO2中氧元素的化合价为+2价
D.水通电得到氧气的化学方程式是2H2O=O2↑+2H2↑
【考点】化学符号及其周围数字的意义;化学式的书写及意义;有关元素化合价的计算;书写化学方程式.
【分析】A、根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,进行解答;
B、根据铁元素化合价为+3,氢氧根的化合价为﹣1,利用十字交叉法写出化学式;
C、根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,进行解答;
D、根据书写化学方程式的要求:写配注等,进行判断.
【解答】解:A、根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,两个氧分子应表示为:2O2;故A错误;
B、根据铁元素化合价为+3,氢氧根的化合价为﹣1,利用十字交叉法写出化学式为:Fe(OH)3;故B正确;
C、根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,CO2中氧元素的化合价应表示为:C![]() 2;故C错误;
2;故C错误;
D、根据书写化学方程式的要求:写配注等,可知水通电得到氧气的化学方程式为:2H2O![]() O2↑+2H2↑;故D错误;
O2↑+2H2↑;故D错误;
故选B.
【点评】本题考查了学生对化学用语的书写和理解能力,及化学方程式的正确书写.
5.实验室用草酸(H2C2O4)制取CO的化学方程式为H2C2O4![]() CO↑+X+CO2↑其中X的化学式为( )
CO↑+X+CO2↑其中X的化学式为( )
A.H2O2 B.H2O C.CH4 D.H2
【考点】有关化学式的计算和推断;质量守恒定律及其应用.
【分析】根据化学方程式为H2C2O4![]() CO↑+X+CO2↑利用质量守恒定律来推断物质X的化学式.
CO↑+X+CO2↑利用质量守恒定律来推断物质X的化学式.
【解答】解:由化学方程式为H2C2O4![]() CO↑+X+CO2↑
CO↑+X+CO2↑
根据质量守恒定律可知,在反应前后的原子个数相等,
C原子个数前后相等,而H、O原子个数还不相等,
反应前共2个H原子,则生成物X中含有2个H原子,
反应前共4个O原子,反应后现有3个O原子,则X中应含有1个O原子,
则X的化学式为H2O,
故选B.
【点评】本题考查化学式的确定,学生应能利用习题中的化学方程式和质量守恒定律中的元素守恒、原子守恒来推断物质的化学式,注意守恒方法在解题中的应用.
6.(眉山市中考化学)某有机物R在足量氧气中完全燃烧后的化学方程式如下:2R+13O2![]() 8CO2+10H2O.根据质量守定律,R的化学式为( )
8CO2+10H2O.根据质量守定律,R的化学式为( )
A.C4H10 B.CH4 C.CH4O D.C2H4O2
【考点】质量守恒定律及其应用.
【分析】解此题需根据质量守恒定律,反应前后原子种类和个数都不变,分别统计出反应前后原子种类及个数,比较分析就可以求出所的物质的化学式.
【解答】解:根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知生成物中含有的原子种类及原子个数为C,8;H,20;O,26;已知反应物中含有的原子种类及原子个数为O,26;比较分析可知R中含有C和H元素,其原子个数分别为4和10,故R的化学式为C4H10
故选A.
【点评】此题主要考查学生对质量守恒定律的实际运用,只有掌握了这一知识的内涵,才能自由驾御,正确解答.
7.如图是用来表示物质间发生化学变化的模型示意图,图中“![]() ”、“
”、“![]() ”分别表示两种不同元素的原子.能用该示意图表示的反应是( )
”分别表示两种不同元素的原子.能用该示意图表示的反应是( )
![]()
A.2H2+O2![]() 2H2O B.2H2O
2H2O B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2CO+O2![]() 2CO2 D.H2+Cl2
2CO2 D.H2+Cl2![]() 2HCl
2HCl
【考点】微粒观点及模型图的应用;分子、原子、离子、元素与物质之间的关系.
【分析】化学变化的模型示意图表示:2个不同种原子构成的化合物分子与1个同种原子构成的单质分子发生反应,反应生成2个由不同种原子构成的化合物分子;因此该反应为两种物质生成一种物质的化合反应;
根据该反应中反应物的组成特点及反应的基本类型,可判断所给四个反应中与图示反应相符的一个反应.
【解答】解:由变化的模型示意图,该反应为两种物质(一种化合物与一种单质)发生反应生成一种化合物的化合反应;而B反应为一种物质生成两种物质的分解反应,故反应B与图示反应不符;反应A、D均为单质与单质间发生的化合反应,与图示反应不符;只有反应C的反应物为化合物与单质发生的化合反应与图示反应相符;
故选C.
【点评】构成相同的分子为同种物质的分子,同种原子构成的分子为单质分子,不同种原子构成的分子为化合物分子.
8.小明从化学方程式4P+5O2![]() 2P2O5中总结的信息有:①参加反应的物质是磷和氧气②反应条件是点燃③反应前后分子的总数不变④反应前后元素的种类不变.其中正确的是( )
2P2O5中总结的信息有:①参加反应的物质是磷和氧气②反应条件是点燃③反应前后分子的总数不变④反应前后元素的种类不变.其中正确的是( )
A.①②③ B.①②④ C.①③④ D.②③④
【考点】化学方程式的概念、读法和含义.
【分析】化学方程式的含义有:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等.
【解答】解:由化学方程式4P+5O2![]() 2P2O5可知,参加反应的物质是磷和氧气,反应条件是点燃,反应前后元素的种类不变.
2P2O5可知,参加反应的物质是磷和氧气,反应条件是点燃,反应前后元素的种类不变.
故选B.
【点评】解答本题的关键是要充分理解化学方程式的含义,只有这样才能对化学方程式表示的意义做出正确的判断.
9.在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | X | Y | Z | Q |
反应前质量/g | 8 | 2 | 40 | 5 |
反应后质量/g | 待测 | 24 | 8 | 23 |
下列说法正确的是( )
A.该反应一定是置换反应
B.Y、Q的相对分子质量比一定为11:9
C.参加反应的X、Z的质量比为1:4
D.反应后X的质量为16
【考点】质量守恒定律及其应用;反应类型的判定.
【分析】此题是借助质量守恒定律对反应物生成物先做出判断,再利用质量关系进行求解,反应中反应物质量会减少,生成物质量会增加,从而判断生成物与反应物,即可判断反应的类型,且反应物与生成物质量相等可求出待测的质量,据此回答问题即可.
【解答】解:根据质量守恒定律可知,设待测质量为a,反应前各物质的质量总和=反应后生成各物质的质量总和,则得:8g+2g+40g+5g=a+24g+8g+23g,解得a=0g.
XZ的质量减少为反应物,YQ的质量增加为生成物.
A、置换反应要求反应物与生成物均是一种化合物和一种单质,而该反应没有说明四种物质的种类,所以不能判断该反应一定是置换反应;
B、根据化学方程式的意义可知物质之间的质量比等于其相对分子质量与其化学计量数乘积之比,该反应没有化学计量数的信息,所以无法得到Y、Q的相对分子质量比一定为11:9的结论;
C、由以上分析可知参加反应的X、Z的质量分别为:8g:(40g﹣8g)=1:4,故C正确;
D、由分析可知反应后X的质量是0g,故D错误
故选C.
【点评】本题主要考查了学生根据图表数据分析问题的能力,要学会去伪存真,挖掘出有效数据.然后根据质量守恒定律以及化学反应中的质量关系求解.
10.(眉山市中考化学)“绿色奥运”是2008年北京奥运会的主题之一.为减轻大气污染,在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体.试推测,该无毒混合气体是( )
A.N2和CO2 B.C02和N02 C.C02和O2 D.CO2和SO2
【考点】质量守恒定律及其应用;空气的成分及各成分的体积分数.
【分析】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,可知反应前后各元素种类不变.
【解答】解:由题意可知反应物是CO和NO,即反应物中含有C、N、O三种元素,生成物中也必须只能含有C、N、O三种元素,C中没有N元素,D中没有N元素多了S元素,B中虽然含有C、N、O三种元素,但二氧化氮是有毒气体,故只有A答案正确.
故选A.
【点评】本题主要考查学生运用质量守恒定律进行推断的能力,要能灵活运用质量守恒定律解决实际问题.
11.某化合物X在一定条件下有如下反应:X+6O2![]() 6CO2+6H2O.下列说法正确的( )
6CO2+6H2O.下列说法正确的( )
A.X由碳、氢两种元素组成
B.X中碳、氢两种元素的质量比为1:2
C.X的相对分子质量是174
D.X中碳元素的质量分数为40%
【考点】有关化学式的计算和推断;物质的元素组成;相对分子质量的概念及其计算;元素质量比的计算;元素的质量分数计算;质量守恒定律及其应用.
【分析】由题意,知反应的化学方程式为X+6O2![]() 6CO2+6H2O,根据质量守恒定律:①宏观意义:反应物和生成物的总质量不变;元素种类、质量不变;②微观意义:原子种类不变;原子数目不变; 原子质量不变;故可推测X的化学式.
6CO2+6H2O,根据质量守恒定律:①宏观意义:反应物和生成物的总质量不变;元素种类、质量不变;②微观意义:原子种类不变;原子数目不变; 原子质量不变;故可推测X的化学式.
【解答】解:由题意,知反应的化学方程式为X+6O2![]() 6CO2+6H2O,根据质量守恒定律的意义,则X含有6个碳原子、12个氢原子、6个氧原子,故X的化学式为C6H12O6,则:
6CO2+6H2O,根据质量守恒定律的意义,则X含有6个碳原子、12个氢原子、6个氧原子,故X的化学式为C6H12O6,则:
A、X由碳、氢两种元素组成,说法错误,应由碳、氢、氧三种元素组成,故A错误;
B、X中碳、氢两种元素的质量比为1:2,说法错误,正确的质量比为(12×6):(1×12)=6:1,故B错误;
C、X的相对分子质量是12×6+1×12+16×6=180,故C错误;
D、X中碳元素的质量分数为:![]() ×100%=40%,故D正确.
×100%=40%,故D正确.
故选D
【点评】掌握有关化学式的计算和推断方法;掌握质量守恒定律的内容及其应用;掌握相对分子质量的计算、元素质量比的计算、元素质量分数的计算的方法.
12.亚硝酸钠(NaNO2)外观与食盐很相似,有咸味,误食易中毒.区别它们的一种方法是:隔绝空气加热.没有明显变化的是食盐.能分解放出有刺激性气味气体的是亚硝酸钠.此气体可能是( )
A.SO2 B.NO2 C.N2 D.NH3
【考点】质量守恒定律及其应用.
【分析】因为亚硝酸钠分解放出的有刺激性气味气体,所以该气体的元素组成必须不能超出亚硝酸钠中的元素组成,还要注意该气体有刺激性气味.
【解答】解:A、SO2中含有硫元素,而亚硝酸钠中不含有硫元素,所以A是不可能的;
B、NO2中的两种元素在亚硝酸钠中都有,并且该气体也是有刺激性气味的,所以B是正确的.
C、N2是无色无味的气体,所以C是不可能的;
D、NH3中含有氢元素,而亚硝酸钠中没有氢元素,D也是错误的.
故选B.
【点评】由于该反应是分解反应,气体中所含的元素必须在亚硝酸钠中能找到,依据是反应前后元素种类不变.
13.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质质量如下表,则该密闭容器中发生的化学反应类型为( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 4 | 2 | 58 | 5 |
反应后质量/g | 待测 | 27 | 0 | 19 |
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
【考点】质量守恒定律及其应用;反应类型的判定.
【分析】在化学反应后质量增加的是生成物,质量减少的是反应物.
【解答】解:
反应后丙物质减少了58g,是反应物;
乙物质增加了25g,是生成物;
丁物质增加了14g,是生成物;
根据质量守恒定律可知,甲物质是生成物,生成甲的质量是58g﹣25g﹣14g=19g.
由分析可知,丙是反应物,甲、乙、丁是生成物,属于分解反应.
故选A.
【点评】在化学反应中遵循质量守恒定律,参加反应的物质的质量等于反应后生成的物质的质量.
14.下列观点中正确的是( )
A.通过化学变化可以改变原子的种类和个数
B.改变物质的性质一定要通过化学变化
C.在化学变化中原子中的电子数不会发生变化
D.在化学变化中都伴随着能量的变化
【考点】化学反应的实质;物质发生化学变化时的能量变化.
【分析】化学变化中原子的种类和个数不变,物质的性质包括物理性质和化学性质,改变性质不一定发生化学变化,在化学变化中原子中的电子要发生转移,化学变化的过程都伴随着能量的变化.
【解答】解:A、化学变化中原子的种类和个数不变,故A错误;
B、物质的性质包括物理性质和化学性质,改变性质不一定是化学性质,因此不一定通过化学变化,故B错误;
C、在化学变化中原子中的电子要发生转移,因此电子数会发生变化,故C错误;
D、化学变化的过程都伴随着能量的变化,故D正确,
故选D.
【点评】本题考查了化学变化的有关说法,完成此题,可以依据已有的知识进行.
二、填空
15.(眉山市中考化学)为了将汽油发动机尾气中的NO转化为N2,在某催化剂作用下用NH3与NO反应,其化学方程式为:4NH3+6NO![]() 5N2+6H2O;在通常状况下,依据左式前后顺序,反应物与生成物中气体的化学计量数之比= ν(NH3):ν(NO):ν(N2)=4:6:5 .
5N2+6H2O;在通常状况下,依据左式前后顺序,反应物与生成物中气体的化学计量数之比= ν(NH3):ν(NO):ν(N2)=4:6:5 .
【考点】化学方程式的概念、读法和含义.
【分析】化学方程式配平后前面的数字即为化学计量数,另外题干要求在通常状况下,写出各气体的化学计量数之比,而水通常情况下是液态.
【解答】解:化学方程式各物质前面的配平数字即为化学计量数,又因为通常情况下,水是液态,所以气体为NH3、NO、N2,化学计量数之比为ν(NH3):ν(NO):ν(N2)=4:6:5.
故填:ν(NH3):ν(NO):ν(N2)=4:6:5
【点评】本题主要考查化学计量数的理解,属基础知识考查.
16.完成下列反应的化学方程式,在括号内注明反应类型(选填“化合”、“分解”、“置换”
或“复分解”)或回答问题.
(1)实验室加热高锰酸钾制氧气的反应: 2KMnO4![]() K2MnO4+MnO2+O2↑ 、 分解 .
K2MnO4+MnO2+O2↑ 、 分解 .
(2)实验室用锌粒和稀硫酸制氢气的反应: Zn+H2SO4═ZnSO4+H2↑ 、 置换 .
(3)生石灰与水生成熟石灰的反应: CaO+H2O═Ca(OH)2 ;此反应过程中 放出 (选填“吸热”或“放出”)热量.
(4)用澄清石灰水检验二氧化碳的反应: CO2+Ca(OH)2═CaCO3↓+H2O ;
问:为何一般可用澄清石灰水检验少量二氧化碳,却用氢氧化钠溶液吸收较多二氧化碳?
答: 虽然氢氧化钙微溶,但其溶液遇少量CO2即浑浊;因氢氧化钠易溶,故其浓溶液可吸收较多CO2 .
【考点】碳酸钙、生石灰、熟石灰之间的转化;实验室制取氧气的反应原理;氢气的制取和检验;反应类型的判定;书写化学方程式.
【分析】高锰酸钾能分解生成氧气,锌和稀硫酸能发生置换反应生成氢气,氧化钙与水反应放热,二氧化碳能使澄清石灰水变浑浊,常用来检验二氧化碳的存在.
【解答】解:(1)高锰酸钾受热能分解生成锰酸钾、二氧化锰和氧气,所以本题答案为:2KMnO4![]() K2MnO4+MnO2+O2↑,分解;
K2MnO4+MnO2+O2↑,分解;
(2)锌能与硫酸反应生成硫酸锌和氢气,属于置换反应,所以本题答案为:Zn+H2SO4═ZnSO4+H2↑,置换;
(3)氧化钙与水反应生成氢氧化钙同时放出热量,所以本题答案为:CaO+H2O═Ca(OH)2,放出;
(4)二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,氢氧化钙微溶于水,能与水反应生成碳酸钙沉淀,现象明显,用来检验二氧化碳的存在,而氢氧化钠易溶于水,能与较多的二氧化碳反应,常用来吸水二氧化碳,所以本题答案为:CO2+Ca(OH)2═CaCO3↓+H2O,虽然氢氧化钙微溶,但其溶液遇少量CO2即浑浊;因氢氧化钠易溶,故其浓溶液可吸收较多CO2.
【点评】本题考查了常见物质的性质以及相互间的反应,完成此题,可以依据已有的知识进行.
17.对知识的比较和归纳是学习科学的重要方法之一.现有以下3个反应的化学方程式:
①CuSO4+Fe=Cu+FeSO4
②CuO+H2![]() Cu+H2O
Cu+H2O
③SiO2+2C![]() Si+2CO↑
Si+2CO↑
(1)比较反应物和生成物的特点,可归纳出这3个反应的基本反应类型都属于 置换反应 .
(2)从反应条件角度分析,这3个反应应用于生产最早的是(填编号) ① .
【考点】反应类型的判定.
【分析】(1)根据置换反应的定义判断.
(2)根据化学的发展史判断并回答.
【解答】解:(1)置换反应是指一种单质与一种化合物反应,生成另一种单质和另外一种化合物的反应,以上三个反应都符合置换反应的定义.
(2)①CuSO4+Fe=Cu+FeSO4是湿法冶金的反应,在我国的西汉时期就已发现,在《淮南万毕术》一书中就有记载,是这3个反应应用于生产最早的.
故答案为:(1)置换反应;(2)①.
【点评】反应类型是初中化学的基本概念之一,也是考查的重点和热点之一,理解它们的概念,了解分类的依据,掌握它们间区别和联系是解决该类习题的关键.
18.自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用如图表示:
(1)图乙所示反应的基本反应类型为 分解 反应;
(2)D物质中氯元素的化合价为 +1 ;
(3)写出图甲所示反应的化学方程式 H2O+Cl2=HCl+HClO .
【考点】微粒观点及模型图的应用;有关元素化合价的计算;反应类型的判定;书写化学方程式.
【分析】自来水消毒通常用采用通入氯气的方法,从图示可以看出,发生的反应正是氯气与水的反应,生成的次氯酸再发生分解反应.由此可以推知每个模型表示的物质,然后写出化学方程式,本题便迎刃而解.
【解答】解:(1)通过图乙化学反应的模型图可以看出;反应物是一种,生成物是两种,属于分解反应;
(2)通过分析,D物质是次氯酸,化学式为HClO,其中氢为+1价,氧为﹣2价,氯元素的化合价就为+1;
(3)通过甲图的微观粒子、化学反应的模型图可以得出:反应物是水和氯气,生成物是盐酸和次氯酸,各物质的微观个数关系是1:1:1:1,其反应的方程式是:H2O+Cl2=HCl+HClO;
故答案为:(1)分解.
(2)+1;(3)H2O+Cl2=HCl+HClO.
【点评】解答本题要充分理解图中提供的信息,只有这样才能确定物质的种类,也才能正确的判断物质的化学式和反应类型及化合价.
四、(眉山市中考化学)计算题
19.工业上用电解氯化镁方法生产金属镁:MgCl2![]() Mg+Cl2↑.现电解950Kg氯化镁最多能生产多千克单质镁?同时能得到多少千克氯气?
Mg+Cl2↑.现电解950Kg氯化镁最多能生产多千克单质镁?同时能得到多少千克氯气?
【考点】根据化学反应方程式的计算.
【分析】由氯化镁的质量根据化学方程式可以计算出生成镁和氯气的质量.
【解答】解:设生成镁的质量为x,生成氯气的质量为y.
MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
95 24 7

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...