![]()
2018年中山化学模拟试题【解析版含答案】
由于版式的问题,试题可能会出现乱码的现象,为了方便您的阅读请点击全屏查看
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Fe:56 S:16 Cl:35.5 Na:23
一、化学选择题(本题共14小题,每小题只有一个选项符合题意。每小题2分,共2![]() 8分)
8分)
 1.下列生活用品的主要材质属于有机合成材料的是 ( )
1.下列生活用品的主要材质属于有机合成材料的是 ( )
|
|
|
|
|
|
C.玻璃茶杯 |
|
|
2. 下列物质的用途中,错误的是 ( )
A.干冰用于人工降雨 B.石墨可做电极
C.氧气可用作燃料 D.氢氧化钙能改良酸性土壤
3.雄伟壮观的国家大剧院主体建筑表面安装了近2万块钛(Ti)金属板。已知一种Ti原子的原子核内有22个质子和26个中子,该钛原子核外的电子数为 ( )
A.4 B.22 C.26 D.48
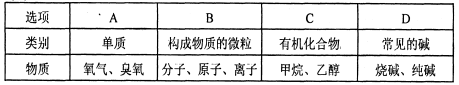
4.分类是一种行之有效、简单易行的科学方法。某同学用下表对所学知识进行分类。下列分类错误的是 ( )
5.在空气中放置较长时间的锌片,表面会形成一层薄膜,其中含有Zn2(OH)2CO3。若该物质通过化合反应生成,则反应物除了Zn外,还应该有①N2 ②O2 ③CO2 ④H2O中的 ( ) ![]()
A.一种 B.两种 C.三种 D.四种
6.下列关于金属说法正确的是 ( )
A.人类使用铝的年代早于金属![]() 铜、铁
铜、铁
B.金(Au)高温条件下也很难与氧气反应
C.通过工业高炉炼铁得到纯净金属铁
D.武德合金熔点高,可用于制造保险丝
7.甲和乙在一定条件下反应生成丙和丁,结合微观示意图分析,下列结论正确的是 ( )

![]()
![]()
![]()
![]()
甲 乙 丙 丁
A.丙的相对分子质量是24 B.发生反应的甲和乙的![]() 质量比为22:3
质量比为22:3
C.反应前后分子总数不变 D.生成的丙和丁的分子个数比为2:1
8.下列关于化学实验操作叙述正确的是 ![]() ( )
( )
A.将试纸直接浸没在溶液中,测定某溶液的pH
B.过滤时,漏斗下端的尖嘴部分需紧贴烧杯内壁
C.未说明药品用量时,一般液体取5毫升左右
D.将氢氧化钠固体![]() 放在衬有纸片的托盘上称量
放在衬有纸片的托盘上称量
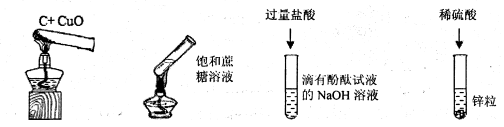
9.根据下列实验现象不能判断有新物质生成的是(图中夹持仪器省略)( )
10.下列各组离子在水中一定能大量共存,并形成无色透明溶液的是( )
|
| A. NH4+、Ba2+、NO3﹣ | B. | H+、Ca2+、HCO3﹣ |
| C | C. Ba2+、OH﹣、SO42﹣ | D. | K+、Na+、MnO4﹣ |
11.右图是甲、乙两种物质的溶解度曲线,则下列叙述正确的是 ( )
 A.可用100g水配制60℃时溶液质量为180g的甲溶液
A.可用100g水配制60℃时溶液质量为180g的甲溶液
B.40℃时,甲、乙两物质溶液的溶质质量分数一定相等
C.升高温度可以将乙的饱和溶液转化为不饱和溶液
D.50℃时,甲物质的溶解度大于乙物质的溶解度
12.某气体由氢气、一氧化碳、甲烷中的一种或几种组成。点燃该气体后,在 火焰上方罩一冷而干燥的烧杯,烧杯内壁出现水雾;把烧杯迅速倒转过来,注 入少量澄清石灰水,振荡,石灰水变混浊。下列对气体组成的推断错误的是 ( )[:]
A.可能只有氢气一种气体 B.可能三种气体都存在
C.可能是甲烷和一氧化碳的混合气体 D.可能只有甲烷一种气体
13.某同学对下列四个实验都设计了两种方案,其中方案1合理、方案2不合理的是 ( )
选项 | A | B | C | D |
实验 目的 | 鉴别NaOH和CaCO3 | 除去NaOH溶液中少量的Na2CO3 | 除去CO2中含有的少量CO | 除去CaO中的CaCO3 |
方案1 | 加水溶解,看是否溶解、放热 | 加适量Ca(OH)2溶液,过滤[:] | 点燃 | 加适量稀盐酸 |
方案2 | 加入盐酸,看是否有气泡产生 | 加适量稀盐酸 | 将气体通入澄清石灰水 | 加水溶解,过滤 |
14.下列叙述与对应的示意图表示正确的是 ( )
A | B | C | D |
| | |
|
向一定量的硫酸铜溶液中加铁粉 | 向一定量pH=2的盐 酸中逐滴加水稀释 | 电解一定质量的水 | 等质量的锌、铁与足量等浓度稀硫酸反应 |
二.化学填空题(本题共5题、共24分)
15.(5分)用化学符号填空
(1)两个金原子 ; (2)标出硫酸中硫元素的化合价 ;
(3)铵根离子 ; (4)白酒中的溶质 .[:]
(5)“侯氏联合制碱法”中的“碱”是 。
16.(4分)豆腐是生活中常见的食品,主要成分如右图所示。
(1)图中所列成分,从营养角度看,共分为_______类。
(2)除豆腐外,很多食物也能提供丰富的蛋白质。下列能提
 供丰富蛋白质的食品是 (填字母序号)。
供丰富蛋白质的食品是 (填字母序号)。



A.苹果 B.鱼 C.馒头
(3)豆腐可以补充人体每天所需的钙元素,缺钙会
导致的疾病是 (填字母序号)。
A.贫血 B.龋齿 C.骨质疏松
(4)家庭制![]() 作豆腐主要有以下的过程:① 打豆浆;
作豆腐主要有以下的过程:① 打豆浆;
② 将豆浆与豆渣分离;③ 点卤;④ 将豆腐花与水分离;⑤ 压制成块。②和④中的两次分离采取的操作是 。
17.(5分)元素周期表中部分元素的相关信息如下,回答下列问题:
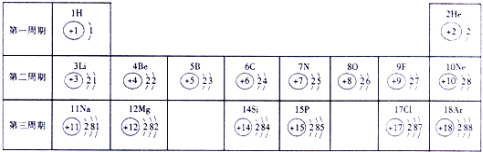
(1)12号元素的原子形成的离子是 (写离子符号),16号元素的原子最外层电子数为 ,地壳中含量最多的金属元素和非金属元素组成的化合物是 (写化学式).
(2) 金属元素的原子在化学反应中易 电子(选填“得”或“失”),稀有气体元素的原子不易得失电子.
(3)在元素周期表中,同一族的元素具有相似的化学性质.则下列各组元素具有相似化学性质的是 。
A.He和Ar B. He和Mg C.Li和Na D.F和Cl.
18.(5分)随着经济的发展,能源与环境成为人们日益关注的问题。
(1)某热水器以天然气为燃气,写出其完全燃烧的化学方程式__________。
(2)煤燃烧生成的CO2、SO2、CO等气体中,会引起温室效应的是__________。
(3)化工厂排放的SO2可用某物质的粉末处理,该过程发生的反应是
2X +2SO2+O2==2CaSO4 +2CO2。X的化学式是__________。
(4)6月5日是世界环境日,中国主题是“向污染宣战”。下列行为中,符合环境日活动主题的是__________。
A.焚烧垃圾 B.开发新能源
C.提倡使用化石燃料 D.工业废水直接排入河中
19.(5分)二氧化氯(ClO2)是一种环保型杀菌消毒剂。在生活中主要用于饮用水的消毒和食品保鲜。用二氧化氯消毒后的水可以直接饮用。
二氧化氯是一种黄绿色、有刺激性气味的有毒气体,密度比空气大,其熔点为-59℃,沸点为11.0℃,易溶于水,且与水反应得到酸性溶液。该气体具有强烈的腐蚀性,吸入高浓度二氧化氯气体会引起咳嗽和呼吸道粘膜的损伤。
二氧化氯极其不稳定,受热或见光易发生爆炸性分解,直接造成氯气泄漏而污染环境,所以只有依靠现场制备。工业上用稍潮湿的氯酸钾(KClO3)和草酸(H2C2O4)在60℃时反应制得。由于制取二氧化氯需要使用的氯酸钾是易爆危险品,所以制备和运输成本很高,因此我国目前还未广泛用其消毒自来水。
请依据文章回答下列问题:
(1)本文介绍了二氧化氯的性质、制法和 等方面内容。
(2)二氧化氯的化学性质有① ;② 。
(3)请将制备二氧化氯反应的化学方程式填写完全:
2KClO3 + 2H2C2O4![]() 2ClO2↑+ 2CO2↑ + K2C2O4 +
2ClO2↑+ 2CO2↑ + K2C2O4 +
(4)发生二氧化氯泄漏时,紧急处理方法是 。
三.简答题 (本题共2题、共16分)
20.(6分)A~J是初中化学常见的物质,它们的相互转化关系如图所示。其中A是一种常见的化肥,不能与碱性物质混合使用;H和D的组成元素相同,I能吸引目前使用最广泛的金属。
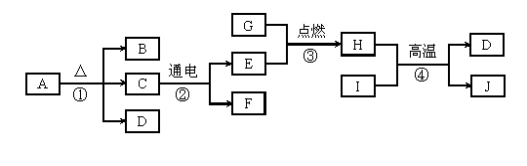
请回答下列问题:
(1)反应①的基本反应类型为 。
(2)B的化学式为 。
(3)反应③的化学方程式为 。
(4)反应④的化学方程式为 。
21.(10分)在20mL溶质质量分数为1.60%![]() 的某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液(发生的反应类似于硫酸铜和氢氧化钠的反应),用电导仪测得溶液的电导率(电导率越高表示溶液的导电性越好)、溶液的pH值随滴入Ba(OH)2溶液体积的变化曲线如下图所示(假设所有稀溶液的密度均为l g/cm3)
的某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液(发生的反应类似于硫酸铜和氢氧化钠的反应),用电导仪测得溶液的电导率(电导率越高表示溶液的导电性越好)、溶液的pH值随滴入Ba(OH)2溶液体积的变化曲线如下图所示(假设所有稀溶液的密度均为l g/cm3)

(1) 硫酸铜和氢氧化钡溶液发生反应的化学方程式为: :
(2) 图I中C点所示溶液中,含量较多的微粒有: ,
D点所示溶液能导电是因为溶液中含有 ;
(3) 从图II中可知:将打磨过的铝片放入上述该硫酸铜溶液中,可以观察到的现象是: ;如有固体析出,请写出反应的化学方程式 。
四.实验题(本题共2题、共22分)
22. (I)(![]() 3分)下图是小红同学设计的一组“吹气球”的实验。请回答:
3分)下图是小红同学设计的一组“吹气球”的实验。请回答:
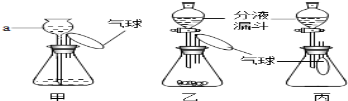
(1)甲装置中,向a中加水会看到气球胀大,一段时间内观察到 ,说明该装置气密性良好。
(2)乙装置中,若锥形瓶中装有NaOH固体,分液漏斗中加入少量水,则气球胀大的主要原因是 。
(3)丙装置中,若锥形瓶中盛满CO2,欲使气球胀大,分液漏斗中的液体可以是 。
(II)(3分)实验室配制50 g 16%的氯化钠溶液的操作如下图所示。
①中玻璃棒的作用是 ;称量的食盐质量为 ;该实验的正确操作顺序为 (填序号)。
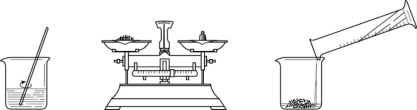
① ② ③
(III)(8分)某实验小组利用下图所示装置进行研究CO2性质和燃烧条件的实验。
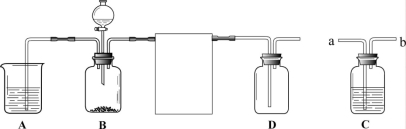
(1)研究CO2与水反应:进行此实验时,将C装置a![]() 、b两端分别与B、D装置连接,A中液体为紫色石蕊溶液,B中固体为碳酸钠,C中液体为浓硫酸,D中放一朵干燥的紫色石蕊小花。将
、b两端分别与B、D装置连接,A中液体为紫色石蕊溶液,B中固体为碳酸钠,C中液体为浓硫酸,D中放一朵干燥的紫色石蕊小花。将![]() 分液漏斗中的稀硫酸滴入B中。A中发生反应的化学方程式为 ;观察到 ,说明使紫色石蕊变色的是碳酸、不是CO2。
分液漏斗中的稀硫酸滴入B中。A中发生反应的化学方程式为 ;观察到 ,说明使紫色石蕊变色的是碳酸、不是CO2。
(2)研究燃烧的条件:进行此实验时,将C装置b、a两端分别与B、 D装置连接,A和C的液体底部靠近导管口分别固定一小块白磷,B中固体为二氧化锰。将分液漏斗中的液体滴入B中。B中发生反应的化学方程式为 ;A液体为冷水,C中液体为 ;观察到 ,说明可燃物燃烧需要与氧气接触、温度达到着火点。
23.(8分)某课外兴趣小组用没有洗净的鸡蛋壳按下表所示步骤进行实验,请在相应空格内填写相关内容。
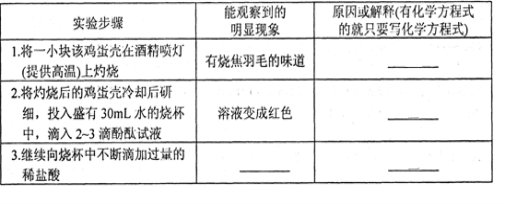
某同学认为上述实验与结论之间的逻辑关系还不十分严密,为更好地说明问题,依据所学化学知识进行推理,需要补做的实验是: 。
五.计算题(本题共2题、共10分)
 24.(4分)人体缺乏维生素C(简写Vc)就会患坏血病.如图为某种“维生素C”说明书的一部分,其中维生素C的化学式部分不清,可用CnH8O6表示。请回答:
24.(4分)人体缺乏维生素C(简写Vc)就会患坏血病.如图为某种“维生素C”说明书的一部分,其中维生素C的化学式部分不清,可用CnH8O6表示。请回答:
(1)“Vc”属于 _________ (填“无机”或“有机”)化合物.
(2)“Vc”中碳、氢的质量比是9:1 ,CnH8O6中n=_________ .
(3)“Vc”中含量最高的是 _________ 元素.
(4)若正常成年人每天最低需要补充“Vc”60mg时,这些“Vc”完全由图中“维生素C”来补充时,则每次至少服用 _________ 片.
25.(6分)食品加工厂在![]() 制作馒头等面食时,经常会用到食用小苏打。与工业制取碳酸氢钠不同,食用小苏打是由纯碱溶液和二氧化碳反应制得:
制作馒头等面食时,经常会用到食用小苏打。与工业制取碳酸氢钠不同,食用小苏打是由纯碱溶液和二氧化碳反应制得:
CO2 + H2O + Na2CO3 === 2NaHCO3。
某温度下,向121.2g碳酸钠溶液中通入一定量的CO2至碳酸钠恰好完全反应,反应后的溶液中有碳酸氢钠析出,过滤,分别得到23.96g固体和106.04 g溶液。
请计算:(1)参与反应的CO2质量。
(2)过滤后的![]() 溶液中,碳酸氢钠与水的质量比。
溶液中,碳酸氢钠与水的质量比。
2018年中山化学模拟试题参考答案
1~14: BCBDC BBBBA DABD
15:(1)2Au;(2)H2![]() O4;(3)NH4+;(4)C2H5OH; (5)Na2CO3
O4;(3)NH4+;(4)C2H5OH; (5)Na2CO3
16.(4分)(1)六 (2)B (3)C (4)过滤
17.(1)Mg2+ 6 Al2O3 (2)失去 (3)ACD
18 (5分) (1)CH4+2O2![]() CO2+2H2O (2)CO2
CO2+2H2O (2)CO2
(3)CaCO3 (4)B
19.(5分)(1)用途(2)能与水发生化学反应 腐蚀性 不稳定性等
![]() (3)2H2O(4)洒水
(3)2H2O(4)洒水
20.(1)分解反应 (2)NH3 (3)2C + O2 点燃![]() 2CO
2CO
4CO+Fe3O4高温 3Fe+4CO2
21. (10分)
(1)CuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2↓(2分)
(2)H2O(1分)
较多的自由移动的Ba2+、OH-(各1分,共2分,多写倒扣,0分为止)
(3)铝片表面有气泡,且表面有红色固体析出,溶液由蓝色变成无色(各1分,3分,多写错1个倒扣1分,0分为止。)
2Al - 3 CuSO4 = Al2(SO4)3 + 3Cu (2分)
2![]() 2. (I)(3分)(每空1分)
2. (I)(3分)(每空1分)
(1)气球大小没有明显变化
(2)NaOH溶于水放热,使瓶内气体膨胀,导致瓶内压强增大
(3)NaOH等可溶性碱溶液(答“水”也可)
(II) .(3分)加快溶解 8 g ②③①
(III).(.8分)
(1)H2O + CO2 === H2CO3
A中紫色石蕊溶液变红,D中干燥紫色小花不变色
(2)2H2O2 二氧化锰 2H2O + O2 ↑ 热水
A中白磷不燃烧,C中白磷在液面下时不燃烧,露出液面后开始燃烧
23.(8分)
能观察到的明显现象 | 原因或解释(有化学方程式的就只要写化学方程式) |
------ | 没有洗净的鸡蛋壳中有蛋白质,蛋白质灼烧时有烧焦羽毛的味道(1分) |
----- | CaCO3 CaO + H2O = Ca(OH)2(1分) |
溶液从红色变成无色(1分) 溶液中有大量气泡(1分) | Ca(OH)2 CaCO3 + 2HCl |
将没有灼烧过的鸡蛋壳研细后放入水中,然后滴入酚酞。(1分)
24. 解:(1)有机;
(2)6
(3))氧;
(4)2片。
25..(6分)(1)8.8g (2)1:10

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...