此试题可能存在乱码情况,在查看时请点击右上角全屏查看
2018年桂林中考化学冲刺试题
一、选择题
1.厨房里的下列操作中,发生了化学变化的是( )
A.拉面条 B.磨豆浆 C.切黄瓜 D.酿米酒
2.2014年“六•五”世界环境日中国的主题为“向污染宣战”.下列做法符合这一主题的是( )
A.通过焚烧秸杆为农作物提供养分
B.通过加高烟囱排放工业废气
C.提倡步行、骑自行车等“低碳”出行方式
D.施用大量的化肥和农药以提高农作物产量
3.下列属于合成材料的是( )
A.不锈钢 B.蚕丝 C.腈纶 D.乙醇
4.超临界流体是物质介于气态和液态之间的新状态,目前应用最广泛的是超临界二氧化碳,超临界CO2流体是一种具有和水相似、能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”.下有关“超临界二氧化碳”列说法正确的是( )
A.它不能与石灰水反应
B.超临界二氧化碳是合成的一种新物质
C.超临界CO2流体性质特殊,但它与干冰的化学组成相同
D.超临界CO2流体是一种特殊的物质,容易燃烧
5.下列对分子、原子、离子的认识,正确的是( )
A.原子是最小的粒子,不可再分
B.温度越高,分子运动速率越快
C.离子不能直接构成物质
D.固体难压缩,说明固体分子间无间隔
6.农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是( )
A.NH4NO3 B.Ca(H2PO4)2 C.(NH4)2HPO4 D.KNO3
7.某同学在实验室测定了几种溶液的pH,其结果如下表:
溶液 | 盐酸 | CuCl2溶液 | Na2SO4溶液 | 水 | Na2CO3溶液 | NaOH溶液 |
pH | <7 | <7 | =7 | =7 | >7 | >7 |
该同学由此得出的结论正确的是( )
A.盐溶液可能显酸性、碱性或中性
B.pH>7一定是碱溶液
C.pH=7一定是盐溶液
D.pH<7一定是酸溶液
8.某化学兴趣小组,为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如图所示的实验操作,其中可以达到实验目的组合是( )
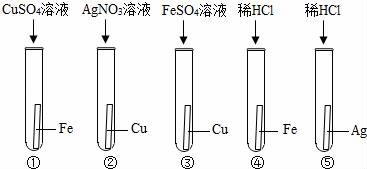
A.①③ B.②④ C.④⑤ D.②③
9.下列除去杂质(在括号内)选用的试剂(在箭头右侧)正确的是( )
A.CO2(CO)→点燃 B.C粉(CuO)→稀盐酸
C.CaCl2溶液(HC1)→石灰水 D.NaOH(Na2CO3)→稀盐酸
10.推理是化学学习中常用的思维方法,下列推理正确的是( )
A.分子是构成物质的微粒,物质都是由分子构成的
B.有机化合物一定含有碳元素,含碳元素的化合物一定是有机化合物
C.中和反应生成盐和水,生成盐和水的反应一定是中和反应
D.活泼金属能与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质不一定是活泼金属
二、非选择题(共10小题,满分40分)
11.化学就在我们身边,它能改善我们的生活.用下列物质序号填空:
A.甲烷B.硫酸C.蛋白质D.小苏打E.食盐
(1)铅蓄电池中含有______;
(2)人体必需的营养素是______;
(3)可以治疗胃酸过多的是______;
(4)日常生活中一种重要的调味品是______;
(5)用作燃料的是______.
12.某同学对大冶湖的水样进行了相关的研究.
(1)湖水属于______(填“纯净物”或“混合物”);
(2)可以采用______来测定湖水的酸碱度(填字母);
A.酚酞试液 B.石蕊试液 C.pH试纸
(3)水体富营养化,造成水华现象,主要原因是河水中______、P两种元素含量过高.
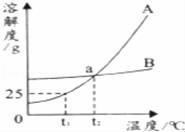
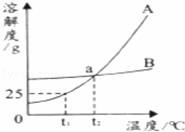
13.如图是甲、乙两物质(均不含结晶水)的溶解曲线,据此回答以下问题:
(1)t1℃时,A物质的溶解度为______g;
(2)a点的含义是______;在t2℃时,A、B两物质的溶解度相同.
(3)从A、B的混合物中分离A物质,一般采用______的方法.
14.用化学用语填空:
①硫酸铜溶液中的阴离子______,②氧化铁中铁元素的化合价______.
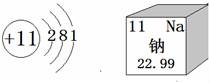
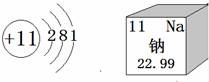
15.如图是钠元素的相关信息,钠元素位于元素周期表第______周期,钠原子在化学反应中易______(填“得到”或“失去”)电子.
16.如图是某化学反应前后的微观示意图,请根据图示回答.
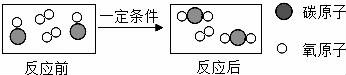
①生成物中碳氧元素质量比为______;
②该反应的基本类型是______;
③写出图示反应的化学方程式______.
17.某学习小组利用下列装置进行气体的制取实验,请分析回答下列问题.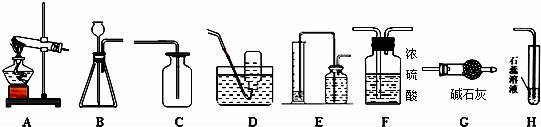
(1)E装置中两种两种玻璃仪器的名称______,______.
(2)若用高锰酸钾制取氧气并测量氧气的体积,可用______,装置相连接.
(3)若用B、C装置连接制取氧气,发生反应的化学方程式为______.
(4)若制取和收集一瓶干燥的二氧化碳,可用三种装置相连接,将二氧化碳气体通入H装置中,发生反应的化学方程式为______.
18.某兴趣小组对物质的性质进行相关探究
【提出问题】氯化氢(HCl)气体显酸性吗?
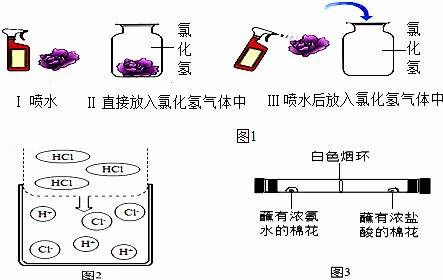
【进行实验】该兴趣小组的同学根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成蓝紫色的纸质干燥小花进行如图1的三个实验:
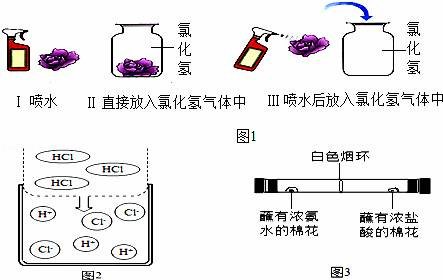
实验现象:Ⅰ和Ⅱ中小花不变色;Ⅲ中小花变红色.
【查阅资料】图2是同学们查阅的氯化氢气体溶于水的示意图.
【实验结论】氯化氢气体不显酸性.
【交流反思】(1)从微观角度分析氯化氢气体不显酸性的原因______.
(2)小明向实验Ⅲ中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式______.
(3)下列实验可以用来说明氯化氢气体不显酸性的是______.
A、测试盐酸的导电性,盐酸能导电B、干燥的碳酸钠粉末放入氯化氢气体中,不反应学C、氢气与氯气反应,生成氯化氢气体D、干燥的碳酸钠粉末放入盐酸中,能反应
【拓展应用】
(4)该兴趣小组的同学为探究分子的运动情况,在玻璃管两端同时放入蘸有试剂的棉花,做了如图3所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵)且偏向蘸有浓盐酸的棉花一端.
①白色烟环偏向蘸有浓盐酸的棉花一端的原因是______.
②写出该反应的化学方程式______.
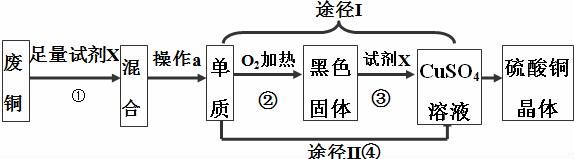
19.硫酸铜晶体常用作杀菌剂.以下是由废铜料(含铁)生产硫酸铜晶体的流程.
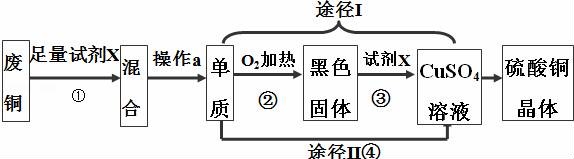
(1)操作 a 的名称是______.
(2)反应①、③的化学方程式分别为①______;③______.
(3)已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径Ⅰ、Ⅱ,途径Ⅰ的优点有:______和______.
CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径Ⅰ、Ⅱ,途径Ⅰ的优点有:______和______.
20.某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数.小刚进行了如图实验.请计算: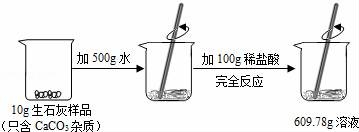
(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数.
2018年桂林中考化学冲刺试题参考答案
一、选择题
1.厨房里的下列操作中,发生了化学变化的是( )
A.拉面条 B.磨豆浆 C.切黄瓜 D.酿米酒
【考点】化学变化和物理变化的判别.
【分析】本题考查学生对物理变化和化学变化的确定.判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
【解答】解:A、拉面条只是形状发生了变化,没有新物质生成,属于物理变化,故A错;
B、磨豆浆只是磨碎提取汁液和营养物质,没有新物质生成,属于物理变化,故B错;
C、切黄瓜只是将黄瓜切断,没有新物质生成,属于物理变化,故C错;
D、酿米酒有新物质乙醇生成,属于化学变化,故D正确.
故选D.
【点评】搞清楚物理变化和化学变化的本质区别是解答本类习题的关键.判断的标准是看在变化中有没有生成其他物质.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.
2.2014年“六•五”世界环境日中国的主题为“向污染宣战”.下列做法符合这一主题的是( )
A.通过焚烧秸杆为农作物提供养分
B.通过加高烟囱排放工业废气
C.提倡步行、骑自行车等“低碳”出行方式
D.施用大量的化肥和农药以提高农作物产量
【考点】空气的污染及其危害;防治空气污染的措施;合理使用化肥、农药对保护环境的重要意义.
【分析】A、从焚烧秸秆时,会污染空气,同时又会烧掉秸杆中的营养成分去分析解答;
B、从加高烟囱排放工业废气,只是把工业废气排放到高空中,还是会造成空气污染去分析解答;
C、从提倡步行、骑自行车等“低碳”出行方式可以减少二氧化碳的排放量,达到少利用化石能源,减少空气污染的目的去分析解答;
D、从提高农作物产量要合理的施用化肥和农药,去分析解答;
【解答】解:A、焚烧秸秆时,大气中二氧化硫、二氧化氮、可吸入颗粒物3项污染指数达到高峰值,其中二氧化硫的浓度比平时高出1倍,二氧化氮、可吸入颗粒物的浓度比平时高出3倍会,会污染空气,同时又会烧掉秸杆中的营养成分,故A错误;
B、加高烟囱排放工业废气,只是把工业废气排放到高空中,还是会造成空气污染,故B错误;
C、提倡步行、骑自行车等“低碳”出行方式可以减少二氧化碳的排放量,达到少利用化石能源,减少空气污染的目的,故C正确;
D、提高农作物产量要合理地施用化肥和农药,防止多余的化肥和农药对环境的污染,故D错误.
故答案为:C.
【点评】减少污染,从我做起,养成保护环境的好习惯.
3.下列属于合成材料的是( )
A.不锈钢 B.蚕丝 C.腈纶 D.乙醇
【考点】合成材料的使用及其对人和环境的影响.
【分析】有机合成材料简称合成材料,要判断是否属于合成材料,可抓住三个特征:有机物、合成、高分子化合物,据此常见材料的分类进行分析判断.
【解答】解:A、不锈钢是铁的合金,属于金属材料,故选项错误.
B、蚕丝属于天然材料,故选项错误.
C、腈纶是合成纤维的一种,合成纤维属于三大合成材料之一,故选项正确.
D、乙醇属于有机物,但相对分子质量较小,属于有机小分子,不属于合成材料,故选项错误.
故选:C.
【点评】本题难度不大,掌握合成材料的三大特征(有机物、合成、高分子化合物)、分类是正确解答此类题的关键所在.
4.超临界流体是物质介于气态和液态之间的新状态,目前应用最广泛的是超临界二氧化碳,超临界CO2流体是一种具有和水相似、能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”.下有关“超临界二氧化碳”列说法正确的是( )
A.它不能与石灰水反应
B.超临界二氧化碳是合成的一种新物质
C.超临界CO2流体性质特殊,但它与干冰的化学组成相同
D.超临界CO2流体是一种特殊的物质,容易燃烧
【考点】二氧化碳的化学性质.
【分析】可以根据超临界二氧化碳的性质方面进行分析、判断,从而得出正确的结论.
【解答】解:A、超临界二氧化碳就是二氧化碳,化学性质没变,故不正确;
B、超临界二氧化碳与其气态或液态之间的转化没有新物质生成,是物理变化,并不是新合成的物质,故D错误;
C、超临界CO2流体性质特殊,但它与干冰的化学组成相同,故C正确;
D、超临界CO2化学性质没变,不容易燃烧,故不正确;
故选C.
【点评】本题以二氧化碳为载体,考查了晶体的辨别、物质性质的判断、环境保护等知识,侧重于考查学生对题中信息的提取和应用能力,题目难度不大.
5.下列对分子、原子、离子的认识,正确的是( )
A.原子是最小的粒子,不可再分
B.温度越高,分子运动速率越快
C.离子不能直接构成物质
D.固体难压缩,说明固体分子间无间隔
【考点】原子的定义与构成;分子、原子、离子、元素与物质之间的关系;分子的定义与分子的特性.
【分析】A、根据原子的构成考虑;B、根据温度与分子运动快慢的关系考虑;C、根据物质构成的基本微粒考虑;D、根据物质分子间间隔存在情况考虑.
【解答】解:A、原子可分为原子核和核外电子,故A错;
B、升高温度,分子获得能量,运动速度加快,故B正确;
C、构成物质的基本微粒有:分子、原子、离子,所以离子能直接构成物质,故C错;
D、固体难压缩,说明固体分子间间隔比较小,故D错.
故选B.
【点评】解答本题关键是要知道原子的构成,分子的特点,构成固体、气体、液体物质的分子之间都有间隔,构成物质的基本微粒有:分子、原子、离子.
6.农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是( )
A.NH4NO3 B.Ca(H2PO4)2 C.(NH4)2HPO4 D.KNO3
【考点】常见化肥的种类和作用.
【分析】含有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥料称为钾肥,同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥.
【解答】解:A、NH4NO3中含有氮元素,属于氮肥,故选项错误.
B、Ca(H2PO4)2中含有磷元素,属于磷肥,故选项错误.
C、(NH4)2HPO4中含有磷元素和氮元素,属于磷复合肥,故选项正确.
D、KNO3中含有钾元素和氮元素,属于复合肥,但不是磷复合肥料,故选项错误.
故选:C.
【点评】本题主要考查化肥的分类方面的知识,确定化肥中营养元素的种类、化肥的分类方法是正确解答此类题的关键.
7.某同学在实验室测定了几种溶液的pH,其结果如下表:
溶液 | 盐酸 | CuCl2溶液 | Na2SO4溶液 | 水 | Na2CO3溶液 | NaOH溶液 |
pH | <7 | <7 | =7 | =7 | >7 | >7 |
该同学由此得出的结论正确的是( )
A.盐溶液可能显酸性、碱性或中性
B.pH>7一定是碱溶液
C.pH=7一定是盐溶液
D.pH<7一定是酸溶液
【考点】溶液的酸碱性与pH值的关系.
【分析】当溶液的pH等于7时,呈中性;当溶液的pH大于7时,呈碱性,当溶液的pH小于7时,呈酸性;
【解答】解:A、CuCl2溶液的pH小于7,显酸性;Na2SO4溶液的pH等于7,显中性;Na2CO3溶液的pH大于7,显碱性,因此盐溶液可能显酸性、碱性或中性,故选项正确.
B、Na2CO3溶液的pH大于7,显碱性,但是碳酸钠溶液是盐溶液,故选项错误.
C、水的pH等于7,显中性,因此pH=7的溶液不一定是盐溶液,故选项错误.
D、CuCl2溶液的pH小于7,显酸性,但CuCl2溶液是盐溶液,不是酸溶液,故选项错误.
故选A.
【点评】本题难度不大,掌握溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键.
8.某化学兴趣小组,为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如图所示的实验操作,其中可以达到实验目的组合是( )

A.①③ B.②④ C.④⑤ D.②③
【考点】金属活动性顺序及其应用.
【分析】在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来;可根据“反应则活泼,不反应则不活泼”进行分析判断,通过分析方案所能得到的结论,确定是否能得出Ag、Fe、Cu三种金属的活动性顺序,判断可以达到实验目的组合.
【解答】解:A、①中铁能与硫酸铜反应,说明铁的金属活动性比铜强,即Fe>Cu;③中铜不能与硫酸亚铁溶液反应,说明铜的金属活动性比铁弱,即Fe>Cu;该组合无法得出Ag、Cu两种金属的活动性顺序,故选项错误.
B、②中铜能与硝酸银溶液反应,说明铜的金属活动性比银强,即Cu>Ag;④中铁能与稀盐酸反应,说明铁的金属活动性比氢强,即Fe>H;该组合无法得出Fe、Cu两种金属的活动性顺序,故选项错误.
C、④中铁能与稀盐酸反应,说明铁的金属活动性比氢强,即Fe>H;⑤中银不能与稀盐酸反应,说明银的金属活动性比氢弱,即H>银;该组合无法得出Fe、Cu两种金属的活动性顺序,故选项错误.
D、②中铜能与硝酸银溶液反应,说明铜的金属活动性比银强,即Cu>Ag;③中铜不能与硫酸亚铁溶液反应,说明铜的金属活动性比铁弱,即Fe>Cu;该组合能得出Ag、Fe、Cu三种金属的活动性顺序为Fe>Cu>Ag,故选项正确.
故选D.
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键.
9.下列除去杂质(在括号内)选用的试剂(在箭头右侧)正确的是( )
A.CO2(CO)→点燃 B.C粉(CuO)→稀盐酸
C.CaCl2溶液(HC1)→石灰水 D.NaOH(Na2CO3)→稀盐酸
【考点】物质除杂或净化的探究;常见气体的检验与除杂方法;酸的化学性质;盐的化学性质.
【分析】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
【解答】解:A、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误.
B、CuO与稀盐酸反应生成氯化铜和水,碳粉不与稀盐酸反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确.
C、HC1能与氢氧化钙溶液反应生成氯化钙和水,但容易引入新的杂质氢氧化钙,故选项所采取的试剂错误.
D、Na2CO3和NaOH均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
故选:B.
【点评】物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.
10.推理是化学学习中常用的思维方法,下列推理正确的是( )
A.分子是构成物质的微粒,物质都是由分子构成的
B.有机化合物一定含有碳元素,含碳元素的化合物一定是有机化合物
C.中和反应生成盐和水,生成盐和水的反应一定是中和反应
D.活泼金属能与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质不一定是活泼金属
【考点】分子、原子、离子、元素与物质之间的关系;酸的化学性质;中和反应及其应用;有机物的特征、分类及聚合物的特性.
【分析】A、根据物质是由分子、原子、离子构成的解答;
B、根据碳的氧化物、碳酸盐、碳酸虽含碳,但其性质与无机物类似,因此把它们看作无机物解答;
C、中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水,据此进行分析判断.
D、根据酸的化学性质(能与活泼金属、碳酸盐等反应生成气体)进行分析判断.
【解答】解:
A、分子是构成物质的微粒,但原子、离子也可以构成物质,故错误;
B、碳的氧化物、碳酸盐、碳酸虽含碳,但其性质与无机物类似,因此把它们看作无机物,故错误;
C、有盐和水生成的反应不一定是中和反应,如CO2+Ca(OH)2═CaCO3↓+H2O,故错误;
D、活泼金属能与稀硫酸反应放出气体,但能与稀硫酸反应放出气体的物质不一定是活泼金属,也可能是碳酸盐等,故正确.
答案:D.
【点评】本题难度不大,掌握物质的构成、有机化合物的定义,中和反应的特征、盐与化合物的特征、酸的化学性质等是正确解答本题的关键.
二、非选择题(共10小题,满分40分)
11.化学就在我们身边,它能改善我们的生活.用下列物质序号填空:
A.甲烷B.硫酸C.蛋白质D.小苏打E.食盐
(1)铅蓄电池中含有 B ;
(2)人体必需的营养素是 C ;
(3)可以治疗胃酸过多的是 D ;
(4)日常生活中一种重要的调味品是 E ;
(5)用作燃料的是 A .
【考点】常用盐的用途;酸的物理性质及用途;甲烷、乙醇等常见有机物的性质和用途;生命活动与六大营养素.
【分析】物质的性质决定物质的用途,根据已有的物质的性质进行分析解答即可.
【解答】解:(1)铅蓄电池中含有硫酸.故填:B;
(2)人体必需的营养素是蛋白质,故填:C;
(3)小苏打是碳酸氢钠,能和酸反应,可以治疗胃酸过多,故填:D;
(4)食盐可用于炒菜调味,故填:E;
(5)甲烷具有可燃性,用作燃料,故填:A;
答案:(1)B;(2)C;(3)D;(4)E;(5)A.
【点评】本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键.
12.某同学对大冶湖的水样进行了相关的研究.
(1)湖水属于 混合物 (填“纯净物”或“混合物”);
(2)可以采用 C 来测定湖水的酸碱度(填字母);
A.酚酞试液 B.石蕊试液 C.pH试纸
(3)水体富营养化,造成水华现象,主要原因是河水中 N 、P两种元素含量过高.
【考点】富营养化污染与含磷洗衣粉的禁用;溶液的酸碱度测定;纯净物和混合物的判别.
【分析】(1)根据湖水的组成来分析;
(2)测溶液的酸碱度用的是pH试纸;
(3)根据水体富营养化,造成水华现象,主要原因是河水中N、P两种元素含量过高进行解答.
【解答】解:(1)湖水中含有杂质,所以属于混合物;故填:混合物;
(2)酚酞试液、石蕊试液只能测定溶液的酸碱性,不能测酸碱度,测溶液的酸碱度用的是pH试纸;故填:C;
(3)水体富营养化,造成水华现象,主要原因是河水中N、P两种元素含量过高.故填:N.
【点评】解答本题关键是要知道纯净物和混合物的区别,测定溶液的酸碱性和测定溶液的酸碱度的不同之处,了解水污染的途径.
13.如图是甲、乙两物质(均不含结晶水)的溶解曲线,据此回答以下问题:
(1)t1℃时,A物质的溶解度为 25 g;
(2)a点的含义是 在t2℃时,A、B两物质的溶解度相同 ;在t2℃时,A、B两物质的溶解度相同.
(3)从A、B的混合物中分离A物质,一般采用 冷却热饱和溶液 的方法.
【考点】固体溶解度曲线及其作用;结晶的原理、方法及其应用.
【分析】根据物质的溶解度曲线,分析确定:t1℃时,A物质的溶解度;溶解度曲线角交点的意义;物质的溶解度受温度影响的情况及分离混合物物的方法.
【解答】解:(1)由A物质的溶解度曲线可知,t1℃时,A物质的溶解度为25g;
(2)由A、B物质的溶解度曲线可知:a点的是A、B两物质的溶解度曲线的交点,a定的含义是:在t2℃时,A、B两物质的溶解度相同;
(3)由A、B物质的溶解度曲线可知:A物质的溶解度受温度的影响较大,B物质的溶解度受温度的影响不大.所以,从A、B的混合物中分离A物质,一般采用冷却热饱和溶液的方法.
故答案为:(1)25;(2)在t2℃时,A、B两物质的溶解度相同;(3)冷却热饱和溶液.
【点评】本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.
14.用化学用语填空:
①硫酸铜溶液中的阴离子 SO42﹣ ,②氧化铁中铁元素的化合价 ![]() 2O3 .
2O3 .
【考点】化学符号及其周围数字的意义.
【分析】①硫酸铜溶液中的阴离子是硫酸根离子,写出其离子符号即可.
②化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后.
【解答】解:①硫酸铜溶液中的阴离子是硫酸根离子,其离子符号为:SO42﹣.
②氧化铁中氧元素显﹣2价,铁元素的化合价为+3价;由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后;氧化铁中铁元素的化合价是+3价可表示为![]() 2O3.
2O3.
故答案为:①SO42﹣;②![]() 2O3.
2O3.
【点评】本题难度不大,掌握常见化学用语(化合价、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.
15.如图是钠元素的相关信息,钠元素位于元素周期表第 三 周期,钠原子在化学反应中易 失去 (填“得到”或“失去”)电子.
【考点】原子结构示意图与离子结构示意图;元素周期表的特点及其应用.
【分析】根据元素在元素周期表中的周期数与其原子的核外电子层数相同、原子的最外层电子数与元素性质的密切关系分析回答.
【解答】解:由于元素在元素周期表中的周期数与其原子的核外电子层数相同,钠原子的核外有三个电子层,钠元素位于元素周期表第三周期,钠原子的最外层电子数是1小于4,在化学反应中易失去电子.
故答为:(1)三;(2)得到.
【点评】本题难度不大,灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)、粒子结构示意图的含义是正确解答本题的关键.
16.如图是某化学反应前后的微观示意图,请根据图示回答.
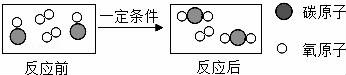
①生成物中碳氧元素质量比为 3:8 ;
②该反应的基本类型是 化合反应 ;
③写出图示反应的化学方程式 2CO+O2![]() 2CO2 .
2CO2 .
【考点】微粒观点及模型图的应用;反应类型的判定;书写化学方程式.
【分析】根据化学反应的微观示意图,分析反应物、生成物,写出反应的化学方程式即可解答;
【解答】解:由图示可知,该反应是一氧化碳和氧气在点燃的条件下生成二氧化碳,方程式为:2CO+O2![]() 2CO2;
2CO2;
①生成物CO2中碳氧元素质量比为:12:(16×2)=3:8;
②由方程式可知,该反应是两种物质生成一种物质的反应,是化合反应;
③方程式为:2CO+O2![]() 2CO2;
2CO2;
故答案为:①3:8;②化合反应;③2CO+O2![]() 2CO2.
2CO2.
【点评】本题主要考查了物质反应的微观示意图,能根据提供的图形信息作出准确的判断,能分清分子的原子构成和反应特点,是解决此类题目的关键.
17.某学习小组利用下列装置进行气体的制取实验,请分析回答下列问题.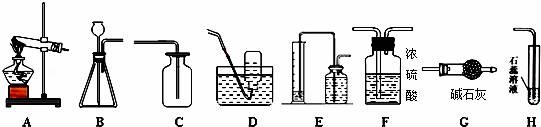
(1)E装置中两种两种玻璃仪器的名称 量筒 , 广口瓶 .
(2)若用高锰酸钾制取氧气并测量氧气的体积,可用 AE ,装置相连接.
(3)若用B、C装置连接制取氧气,发生反应的化学方程式为 2H2O2![]() 2H2O+O2↑ .
2H2O+O2↑ .
(4)若制取和收集一瓶干燥的二氧化碳,可用三种装置相连接,将二氧化碳气体通入H装置中,发生反应的化学方程式为 CO2+H2O=H2CO3 .
【考点】氧气的制取装置;氧气的收集方法;二氧化碳的化学性质;书写化学方程式.
【分析】(1)熟记仪器的名称;
(2)根据制取气体的方法以及收集气体的方法来分析;
(3)根据装置特点确定制取氧气的原理;
(4)根据二氧化碳的性质来分析.
【解答】解:(1)E装置中两种两种玻璃仪器的名称分别为量筒和广口瓶;故填:量筒;广口瓶;
(2)用高锰酸钾制取氧气,属于固体加热型,故选择装置A,收集氧气并测定氧气的体积,可选择装置E,故填:AE;
(3)B装置适用于固液常温下制氧气,则为过氧化氧在二氧化锰作催化剂的条件下生成水和氧气,故填:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(4)二氧化碳与水反应生成碳酸,碳酸能使紫色的石蕊试液变红色,故填:CO2+H2O=H2CO3.
【点评】本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.
18.某兴趣小组对物质的性质进行相关探究
【提出问题】氯化氢(HCl)气体显酸性吗?
【进行实验】该兴趣小组的同学根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成蓝紫色的纸质干燥小花进行如图1的三个实验:
实验现象:Ⅰ和Ⅱ中小花不变色;Ⅲ中小花变红色.
【查阅资料】图2是同学们查阅的氯化氢气体溶于水的示意图.
【实验结论】氯化氢气体不显酸性.
【交流反思】(1)从微观角度分析氯化氢气体不显酸性的原因 在氯化氢气体中,氯化氢气体是由氯化氢分子构成的,没有解离出的氢离子,所以氯化氢气体不显酸性 .
(2)小明向实验Ⅲ中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式 NaOH+HCl═NaCl+H2O .
(3)下列实验可以用来说明氯化氢气体不显酸性的是 B .
A、测试盐酸的导电性,盐酸能导电B、干燥的碳酸钠粉末放入氯化氢气体中,不反应学C、氢气与氯气反应,生成氯化氢气体D、干燥的碳酸钠粉末放入盐酸中,能反应
【拓展应用】
(4)该兴趣小组的同学为探究分子的运动情况,在玻璃管两端同时放入蘸有试剂的棉花,做了如图3所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵)且偏向蘸有浓盐酸的棉花一端.
①白色烟环偏向蘸有浓盐酸的棉花一端的原因是 氨分子的运动速率大于氯化氢分子的运动速率,所以生成的白色烟环偏向蘸有浓盐酸的棉花一端 .
②写出该反应的化学方程式 NH3+HCl═NH4Cl .
【考点】实验探究物质的性质或变化规律;溶液的酸碱性测定;书写化学方程式.
【分析】(1)根据氯化氢气体是由氯化氢分子构成的进行分析;
(2)根据题中所给的反应物、生成物以及反应条件结合质量守恒定律进行分析;
(3)根据碳酸钠粉末遇到酸性物质会生成二氧化碳进行解答;
(4)①根据影响分子运动速率的因素进行分析;
②根据反应物、生成物以及反应条件结合质量守恒定律进行解答.
【解答】解:(1)氯化氢气体是由氯化氢分子构成的,没有解离出的氢离子,所以氯化氢气体不显酸性,故填:在氯化氢气体中,氯化氢气体是由氯化氢分子构成的,没有解离出的氢离子,所以氯化氢气体不显酸性;
(2)氢氧化钠溶液和盐酸反应生成氯化钠和水,所以向实验Ⅲ中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄绿色,反应的化学方程式为:NaOH+HCl═NaCl+H2O;
(3)碳酸钠粉末遇到酸性物质会生成二氧化碳,所以干燥的碳酸钠粉末放入氯化氢气体中,不反应,说明氯化氢气体不显酸性,故填:B;
(4)①相对分子质量越大,分子的运动速率越慢,相对分子质量越小,分子的运动速率越快,氨气的相对分子质量小于氯化氢的相对分子质量,所以氨分子的运动速率大于氯化氢分子的运动速率,所以生成的白色烟环偏向蘸有浓盐酸的棉花一端,所以填:氨分子的运动速率大于氯化氢分子的运动速率,所以生成的白色烟环偏向蘸有浓盐酸的棉花一端;
②在常温下,氨气和氯化氢气体反应生成氯化铵固体,该反应的化学方程式:NH3+HCl═NH4Cl;
故答案为:(1)在氯化氢气体中,氯化氢气体是由氯化氢分子构成的,没有解离出的氢离子,所以氯化氢气体不显酸性;
(2)NaOH+HCl═NaCl+H2O;
(3)B;
(4)①氨分子的运动速率大于氯化氢分子的运动速率,所以生成的白色烟环偏向蘸有浓盐酸的棉花一端;
②NH3+HCl═NH4Cl.
【点评】在解此类题时,首先要了解题中的各个问题,然后将这些问题对准学过的知识点,再结合题中的要求各个突破.
19.硫酸铜晶体常用作杀菌剂.以下是由废铜料(含铁)生产硫酸铜晶体的流程.
(1)操作 a 的名称是 过滤 .
(2)反应①、③的化学方程式分别为① Fe+H2SO4=FeSO4+H2↑ ;③ CuO+H2SO4=CuSO4+H2O .
(3)已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径Ⅰ、Ⅱ,途径Ⅰ的优点有: 不污染环境 和 硫酸的利用率高 .
CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径Ⅰ、Ⅱ,途径Ⅰ的优点有: 不污染环境 和 硫酸的利用率高 .
【考点】物质的相互转化和制备;金属的化学性质;书写化学方程式.
【分析】根据流程图可推断,为了除去废铜料中的铁,加入足量的试剂X是稀硫酸,得到的混合物是铜、硫酸亚铁和剩余的硫酸,应通过过滤得到单质的铜,途径Ⅰ是铜在加热的条件下和氧气反应生成了黑色的固体氧化铜,氧化铜与硫酸反应生成的硫酸铜,途径Ⅱ是铜与浓硫酸在加热的条件下反应生成了硫酸铜二氧化硫和水.据此分析回答有关的问题.
【解答】解:由废铜料(含铁)生产硫酸铜晶体的流程可知,为为了除去废铜料中的铁,加入足量的试剂X是稀硫酸,得到的混合物是铜、硫酸亚铁和剩余的硫酸,应通过过滤得到单质的铜,途径Ⅰ是铜在加热的条件下和氧气反应生成了黑色的固体氧化铜,氧化铜与硫酸反应生成的硫酸铜,途径Ⅱ是铜与浓硫酸在加热的条件下反应生成了硫酸铜二氧化硫和水.由此可知:
(1)操作a为过滤操作,把不与稀硫酸反应的金属铜与硫酸亚铁溶液分离开来;所以,操作 a 的名称是过滤.
(2)反应①是铁与稀硫酸反应生成了硫酸亚铁和氢气,③是氧化铜与硫酸反应生成了硫酸铜和水,化学方程式分别为:①Fe+H2SO4=FeSO4+H2↑;③CuO+H2SO4=CuSO4+H2O.
(3)已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径Ⅰ、Ⅱ,途径Ⅰ的优点有:不产生二氧化硫,不污染环境和硫酸的利用率高.
CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径Ⅰ、Ⅱ,途径Ⅰ的优点有:不产生二氧化硫,不污染环境和硫酸的利用率高.
故答案为:(1)过滤;(2)Fe+H2SO4=FeSO4+H2↑;CuO+H2SO4=CuSO4+H2O;(3)不污染环境和硫酸的利用率高.
【点评】根据生产流程图,正确理解每个过程在生产中的作用,从而达到全面掌握生产过程的目的,为解答问题做足准备.
20.某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数.小刚进行了如图实验.请计算: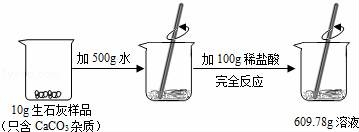
(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数.
【考点】根据化学反应方程式的计算.
【分析】根据反应前后的质量差可以求出生成二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量.
【解答】解:(1)反应前后的质量差即是生成的二氧化碳的质量,生成的二氧化碳的质量为:10g+500g+100g﹣609.78g=0.22g,
答:生成CO2气体的质量为0.22g.
(2)解:设样品中CaCO3的质量为X,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 0.22g
![]() =
=![]()
X=0.5g,
样品中CaCO3的质量分数为:![]() ×100%=5%.
×100%=5%.
答:样品中CaCO3的质量分数为5%.
【点评】解答本题关键是要能够通过反应前后的质量差,求出生成的二氧化碳的质量,其它计算就迎刃而解了.

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...