此试题可能存在乱码情况,在查看时请点击右上角全屏查看
2018年开封中考化学计算题专项训练
1.侯氏制碱法的核心反应原理如下:
NH3 + CO2 + NaCl + H2O == NH4Cl + NaHCO3
某温度下,向溶质的质量分数为20%的氯化钠溶液47.25 g中通入一定量氨气(NH3)
和二氧化碳。充分反应后,将溶液中析出的碳酸氢钠晶体过滤,低温烘干,称量,质
量为4.4 g。计算需要通入氨气的质量。
(已知:该温度下碳酸氢钠饱和溶液中,碳酸氢钠与水的质量比为1:9;且溶液中若存在其它溶质,不会对上述比值产![]() 生影响)。
生影响)。
2.据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜。
![]() (1)请完成该反应的化学方程式:
(1)请完成该反应的化学方程式:
2Cu + 2H2SO4 + O2 2CuSO4 +
(2)某同学想利用此反应,将80 g含铜80%的废料转化为10%的硫酸铜溶液,计算需要加入10%的稀硫酸和水的质量(假设杂质不参加反应,也不溶于水)。
3.合成氨工业生产中所用催化剂的主要成分是FeO和Fe2O3,且FeO与Fe2O3的质量比为9∶20时,其催化活性最大。以Fe2O3为原料制备该催化剂时,可加入适量木炭粉,发生如下反应: 2Fe2O3+C ![]() 4FeO + CO2↑。试计算应向160g Fe2O3 粉末中加入的木炭粉质量。
4FeO + CO2↑。试计算应向160g Fe2O3 粉末中加入的木炭粉质量。
![E:\06—修图软件\新建文件夹\19 [转换].jpg](http://img.chusan.com/upLoad/doc2017/6nbnl79t/164647.004.png) 4.实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如右图所示。
4.实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如右图所示。
(1)实验中生成沉淀的最大质量是 g。
(2)开始加入碳酸钠溶液时,还没有产生沉淀
的原因是 。
(3)计算原滤液中氯化钙的质量分数。
(已知:CaCl2+Na2CO3=CaCO3↓+2NaCl)
5.某化工厂生产的纯碱产品(含有少量氯化钠)的包装袋上注明:碳酸钠≥96%。
为了测定该产品中碳酸钠的质量分数是否属实,向4个分别盛有浓度相同、质量均为100 g稀盐酸的烧杯中,分别放入不同质量的纯碱产品,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:
所称量的物质 | 实验1 | 实验2 | 实验3 | 实验4 |
加入纯碱产品质量/g | 2.8 | 5.6 | 11.2 | 14 |
烧杯中剩余物质量/g | 101.7 | 103.4 | 106.8 | 109.6 |
请计算(最后结果保留一位小数):
(1)该纯碱产品中碳酸钠质量分数的标注![]() 是否真实。
是否真实。
(2)所用盐酸溶液中溶质的质量分数。
(3)恰好完全反应时,所得溶液中溶质的质量分数。
6.过氧化氢的水溶液俗称双氧水,在放置过程中会缓慢分解。现有一瓶未曾使用过的、久置的双氧水,瓶上商品标签提供了如下信息:
①H2O2的质量分数为30%; ②内装溶液质量1 000 g。
经实验测定,其中H2O2的质量分数现仅为10%。 请计算: 新-课 -标-第-一- 网
(1)若用这瓶双氧水来配制3%的医用双氧水1500 g,需用这种双氧水的质量是多少?
(2)计算这瓶双氧水中已分解的过氧化氢的质量。
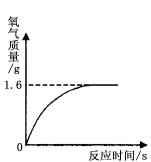 7.过氧化氢溶液在存放过程中会自然分解,使溶质质量分数减小。某同学使用一瓶原标注为30%的过氧化氢溶液完成制取氧气的实验。通过称量,该瓶中共有116.8 g溶液,取出13.6 g在一定条件下进行实验,发现生成气体的质量与反应时间的关系如右图所示。试计算
7.过氧化氢溶液在存放过程中会自然分解,使溶质质量分数减小。某同学使用一瓶原标注为30%的过氧化氢溶液完成制取氧气的实验。通过称量,该瓶中共有116.8 g溶液,取出13.6 g在一定条件下进行实验,发现生成气体的质量与反应时间的关系如右图所示。试计算
⑴现在这瓶过氧化氢溶液的溶质质量分数。
⑵该瓶溶液中,已经分解的过氧化氢质量。
8.盐水选种是我国古代劳动人民发明的一种巧妙的挑选种子的方法。农业生产上常用溶质质量分数为15%-20%的氯化钠溶液来选种。
(1)要配置150kg16%的氯化钠溶液,计算应称取氯化钠的质量。
(2)选种进行一段时间后,农技员估计溶液和溶质质量分数都有所减少,他取出50g氯化钠溶液,加入过量AgNO3溶液,得到沉淀14.35g,计算氯化钠溶液中溶质的质量分数。
(反应原理为:AgNO3+ NaCl = AgCl↓+NaNO3)
(3)若此时氯化钠溶液的质量只剩下100kg,要使溶液质量和溶质质量分数都恢复到(1)中的状态,计算需要加入的氯化钠和水的质量。
9.盐碱湖中捞出来的纯碱中含有一定量的食盐,为测定其中碳酸钠的含量,化学小组的同学将某纯碱样品24.6g放入烧杯中,逐滴加入150g稀盐酸,恰好完全反应,待不再产生气泡时,得到168g的食盐溶液。计算原混合物中碳酸钠的质量分数和反应后溶液的溶质质量分数(CO2的溶解忽略不计)。
![]() 10.在电缆生产过程中会产生一定量的含铜废料。据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜,该反应的化学方程式为:
10.在电缆生产过程中会产生一定量的含铜废料。据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜,该反应的化学方程式为:
2Cu + 2H2SO4 + O2 2CuSO4 +2H2O。若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数。
11.由醋酸溶液和醋酸钠溶液混合而成的缓冲溶液(其中醋酸的质量分数为2.5%)在农业上常用于土壤分析、农用微生物的培育等。某同学用5%的醋酸溶液和400 g10%的氢氧化钠溶液混合配制该缓冲溶液,所需醋酸溶液的质量为多少克?(资料:反应的化学方程式为:NaOH + CH3COOH = CH3COONa + H2O)
12.现有Cu与另一种金属(可能是Mg、Fe、Zn中的一种)形成的粉末。现欲测定其组成,进行如下实验:取该粉末16g放入烧杯,将溶质质量分数为14%的稀硫酸280.0g分4次加入该烧杯中,充分反应后,测得剩余的固体质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 70.0 | 70.0 | 70.0 | 70.0 |
剩余固体质量/g | 13.6 | 11.2 | 8.8 | 8.4 |
计算(要求写出计算过程):
(1)该粉末中Cu的质量分数。
(2)该粉末中另一种金属为何种金属。
(3)第3次加入稀硫酸充分反应后,所得溶液中溶质的质量分数。
2018年开封中考化学计算题专项训练参考答案
1.(3分)1.7 g
给分点参考如下:
(1)利用1:9建立溶质与溶剂质量关系 1分
(2)能找出反应中NH3、H2O、NaHCO3质量关系 1分
(3)求出氨气的质量为1.7 g 1分
![]() 解题过程参考如下:
解题过程参考如下:
【解】设:需要氨气的质量为![]() 。
。
NH3 + CO2 + NaCl + H2O ==== NH4Cl + NaHCO3
17 18 84
![]()
![]()
![]() 1分
1分
 =
= ![]()
![]() 2.(3分)
2.(3分)
(1)2H2O
(2)解:设生成硫酸铜的质量为x,生成水的质量y,消耗H2SO4的质量为z。
2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O
128 196 320 36
80g×80% z x y
![]()
![]()
![]()
![]()
![]()
![]()
![]() —— = —— = —— = ——
—— = —— = —— = ——
![]()
![]() =160 g y =18 g z = 98 g
=160 g y =18 g z = 98 g
![]() 稀硫酸溶液的质量= = 980 g … ……………… (1分)
稀硫酸溶液的质量= = 980 g … ……………… (1分)
硫酸铜溶液的质量= = 1600 g
加入水的质量= 1600 g―160 g―18 g―980 g×90% = 540 g ………… (1分)
答:略。
3.解:设生成FeO的质量为x;需加入木炭粉的质量是y。
2Fe2O3 + C ![]() 4FeO十CO2↑
4FeO十CO2↑
320 12 288
y x
反应后剩余Fe2O3的质量为:![]()
参加反应Fe2O3的质量为:160 g- ![]() ……………………1分
……………………1分
则列式: ![]()
解得:x=48g ……………………1分
列式:![]() =
= ![]()
答:需加入木炭粉2 g
4.(1)5 ·········································1分
(2)稀盐酸先与碳酸钠反应 ·································1分
(3)解:设原滤液中CaCl2的质量为x
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl
111 100
![]()
![]() x 5g
x 5g
x=
![]()
原滤液中CaCl2的质量分数= ·················1分
答:原滤液中氯化钙的质量分数是11.1%。
5.【解】盐酸完全反应时,生成二氧化碳的质量为100 g﹢11.2 g﹣106.8 g﹦4.4 g。
设:纯碱产品中碳酸钠质量为x,稀盐酸中溶质的质量为y,生成氯化钠的质量为z。
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
106 73 117 44
x y z 4.4 g
x = 10.6 g y = 7.3 g z = 11.7 g
(1)纯碱产品中碳酸钠的质量分数![]() 标注不真实。
标注不真实。
(2)盐酸溶液中溶质质量分数![]()
(3)氯化钠溶液中溶质质量分数![]()
6.设所需这种双氧水的质量为x, 则x×10%=1 500 g×3%, X=450g --------1分
(2) 设这瓶双氧水变质过程中减少的过氧化氢的质量为y
2H2O2MnO22H2O+O2↑
68 32
y 32/68Y
余下溶质H2O2的质量为300g-y,余下溶液的质量为1000g-32/68Y。
再根据变质后溶液中溶质的质量分数为10%列出长等式:
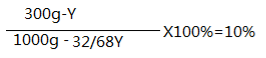 ----------------1分
----------------1分
求出y=209.9----------------1分
![]() 7.解:⑴设13.6 g过氧化氢溶液中溶质的质量为x。
7.解:⑴设13.6 g过氧化氢溶液中溶质的质量为x。
2H2O2 2H2O + O2↑
68 32
x 1.6 g
![]() x=3.4g
x=3.4g
该溶液中溶质的质量分数= ![]() ……………………(1分)
……………………(1分)
![]() ⑵设已分解的过氧化氢的质量为y ,产生氧气的质量为z。
⑵设已分解的过氧化氢的质量为y ,产生氧气的质量为z。
2H2O2 2H2O + O2↑
68 32
y z
![]() z =
z =![]()
[y+116.8g×25%]/(116.8+![]() )=30%
)=30%
y+29.2=35.04+9.6/68 y
![]() 58.4/68y=5.84
58.4/68y=5.84
y=6.8g
答略
8.解:(1)150kg×16%=24 kg --------------(1)
(2) 设生成氯化钠的质量为X
AgNO3+ NaCl = AgCl↓+NaNO3
58.5 143.5
X 14.35g
58.5 :143.5 = X :14.35 g
X =5.85 g
(5.85/50)×100%=11.7%------------(1)
需要加入氯化钠的质量为:24 kg﹣100 kg×11.7%=12.3 kg
需要加入水的质量为:150 kg﹣100 kg﹣12.3 kg=37.7 kg ![]() ------------(1)
------------(1)
9.设: 原混合物中碳酸钠的质量为X ,生成氯化钠的质量为Y,生成二氧化碳的质量为z。
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
106 117 44
X Y 6.6g
![]()
![]()
X=15.9g Y=17.6g
10.2000g×3.2%=64 g
设需硫酸的质量为x,参加反应氧气的质量为y, 生成硫酸铜的质量为z
![]()
2Cu + 2H2SO4 + O2 2CuSO4 +2H2O
128 196 32 320
64 g x y z
![]()
![]() =
=![]() =
=![]() =
=![]()
![]() x=98 g y=16 g z =160 g
x=98 g y=16 g z =160 g
98 g÷9.8%=1000g
![]()
![]() ×100%=14.8%
×100%=14.8%
答:反应后所得硫酸铜溶液中溶质的质量分数为14.8%。
11.解:设:40![]() 0 g10%的氢氧化钠溶液和醋酸溶液反应,消耗的醋酸的质量为X
0 g10%的氢氧化钠溶液和醋酸溶液反应,消耗的醋酸的质量为X
NaOH + CH3COOH=CH3COONa + H2O
![]() 400 g×10% X
400 g×10% X
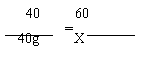 = 40g
= 40g
X = 60g
设:反应后溶液中醋酸的质量为Y
![]()
![]() Y÷2.5% = (60g + Y) ÷5% + 400 g
Y÷2.5% = (60g + Y) ÷5% + 400 g
![]() Y = 80g[来源:学。科。网]
Y = 80g[来源:学。科。网]
12.(1)该粉末中Cu的质量分数为![]() ……………………(1分)
……………………(1分)
(2)[解]设:另一种金属为M,其相对分子质量为x
分析表格中数据可知每70g稀硫酸与2.4g金属M恰好完全反应
![]() M + H2SO4 === MSO4 + H2↑
M + H2SO4 === MSO4 + H2↑
![]()
![]() x 98
x 98
2.4g ![]()
x = 24
该金属为镁 ……………………………………………… (1分)
(3)[解]第3次加入稀硫酸充分反应后,消耗金属镁的质量为7.2g。
设:此时生成MgSO4 的质量为y,生成 H2的质量为z
M g + H2SO4 === MgSO4 + H2↑
24 ![]() 120 2
120 2
7.2g y z
![]() y = 36 g
y = 36 g
![]() z = 0.6 g
z = 0.6 g
则此时所得溶液中溶质质量分数为![]() (1分)
(1分)
答:略

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...