此试题可能存在乱码情况,在查看时请点击右上角全屏查看
2018年常德中考化学冲刺试题
题号 | 一 | 二 | 三 | 四 | 五 | 总分 | 累分人 |
得分 |
|
|
|
|
|
|
|
说明:1.本卷共有六大题,31小题。全卷满分100分,考试时间为120分钟。
2.本卷可能用到的相对原子质量:K—39 I—127 C—12 H—1 O—16 N—14 Ca—40
选择题(本大题包括10小题,共20分。每小题只有一个选项符合题意,请将正确选项的序号填入题后的括号内)
1. 电能是现代生产,生活中不可缺少的二级能源,转化为电能的方式有多种,下列能量转化方式由化学能转化为电能的有 ( )
A.水力发电 B.电池 C.风力发电 D.电解水
2. 使用滴管吸取少量液体时,操作正确的是 ( )
A.把滴管伸入试剂瓶中吸取液体。
B.把取液后的滴管倒置。
C.把取液后的滴管伸入试管中或量筒中。
D.滴瓶上的滴管取液后,立即用水冲洗干净。
3. 人体中几种体液的pH范围如下表
体液 | 胃液 | 血液 | 小肠液 | 胆汁 | 唾液 |
pH | 0.9—1.5 | 7.35—7.45 | 7.6 | 7.1—7.3 | 6.6--7.1 |
所列体液中碱性最强的是 ( )
A.唾液 B.血液 C.胆汁 D.小肠液
4. 医学研究表明,偏硅酸有软化血管的作用,对心脏病,高血压有一定的疗效。偏硅酸是二元酸又是含氧酸,其中硅的化合价为+4价,则化学式为 ( )
A.SiO2 B.H2SiO4 C.Na2SiO3 D.H2SiO3
5. 中国科学技术大学钱逸泰教授等以CCl4和金属钠为原料,在700℃制造出纳米级金刚石粉末,该成果发表在世界最权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此的一些“理解”不正确的是 ( )
A. CCl4是一种化合物 B.制造金刚石过程中发生化学变化
![]() C. 金刚石属于金属单质 D.这个反应可能置换反应
C. 金刚石属于金属单质 D.这个反应可能置换反应
6. 公寓突然发生火灾,由五楼厨房起火燃烧,六楼冒出浓烟,下列何者为四楼住户最佳的逃生方式 ( )
A.以湿布掩住口鼻,在原地等待救援。
B.以工具打破窗户,直接跳楼逃生。
C.由楼梯迅速往一楼的方向逃生。
D.采低姿势往顶楼的方向逃生。
7. 下列工农业生产,日常生活中化学知识运用错误的是 ( )
A.用食醋除去水管中的水垢 B.冰箱内放置木炭除异味
C.用稀盐酸除铁锈 D.在铁桶内配制农药波尔多液
8. 根据右图的溶解度曲线,判断下列洗法不正确的是 ( )
 A.t1℃时的甲物质的溶解度小于乙物质的溶解度
A.t1℃时的甲物质的溶解度小于乙物质的溶解度
B.t2℃时,甲、乙两物质的饱和溶液中含有甲、乙两
物质的质量相等。
C.将t3℃的甲、乙两物质的饱和溶解降温至t2℃时,
都含析出晶体。
D.当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲
9.下列常见物品中,不属于合成材料制作的是 ( )
A.纯羊毛线编制的毛衣 B.种植蔬菜搭棚用的塑料薄膜
C.可用作食品包装袋的聚乙烯 D.制作“天堂牌”雨伞的尼龙布
10. 以下说法错误的是 ( )
A.干冰不是冰 B.铅笔不是铅 C.水银不是银 D.烧碱不是碱
二. 选择填充题(本大题包括5小题,每小题2分,共10分。先在A、B、C中选择一个正确选项填入题后的括号内,然后在D处再补充一个正确答案。每小题的选择与填充各1分)
11. 实验室用双氧水制氧气和用石灰石跟稀盐酸制CO2相比较,下列说法中正确的是( )
A.都可用向上排空气法收集 B.都可用排水法收集
C.都是分解反应 D.
12. 下列饮料中,不属于溶液的是 ( )
A.雪碧 B.酸奶 C.啤酒 D.
13. 下列物质属于无机化合物的是 ( )
A.蛋白质 B.葡萄糖 C.纯碱 D.
14. 在“氧气的制取和性质”实验中,某同学取一根纱窗上的细铁丝,在自己收集到的氧气中做“铁丝在氧气中燃烧”的实验,结果没有观察到“火星四射”的现象。造成此实验失败的原因可能的是 ( )
A.收集到的氧气量太少或纯度不够 B.铁丝很细
C.集气瓶底部没有铺一薄层细沙 D.

15. 某元素的原子结构示意图为 下列关于该元素说法正确的是 ( )
A.它的是带1个单位正电荷阳离子 B.它的阳离子有10个质子
C.它是一种金属元素 D.
三.填空题(本大题包括4小题,每空1分,共25分)
16.(10分) (1)在H、O、C、Cl、Ca五种元素中,选择适当元素,组成符合下列要求的物质,将其化学式填入空格内
①可用于人工降雨的氧化物
②可用于金属表面除锈的酸
③可用于改良酸性土壤的碱
④可作建筑材料的盐
⑤可做干燥剂的氧化物
⑥最轻的氧化物
⑦最简单的有机物
(2)写出符合下列要求的化学反应方程式,所用的反应物必须从上述五种元素中选择适当的元素组成
①化合反应
②分解反应
③复分解反应
17.(4分) 下表是市场上销售的某加碘食盐包装袋上的部分文字说明(I为碘的元素符号),请根据表中提供的信息回答下列问题:
氯化钠(NaCl) | 以NaCl计≥98.0% |
碘酸钾(KIO3) | 以I计20mg~40mg/kg |
(1)包装袋上所指碘的含量是__________。(填“单质碘”、“碘酸钾”或“碘元素”)
(2)碘酸钾中碘元素的化合价是________,碘元素的质量分数是____________。
 (3)该加碘食盐是_________。(填“纯净物”或“混合物”)
(3)该加碘食盐是_________。(填“纯净物”或“混合物”)
18. (4分)右面的方框内是某食品包装上的
部分说明,请从其中标出的配料中选出一种符
合条件的物质填在下列相应的空格中:
(1)_________________中富含蛋白质;
(2)__________________中富含油脂;
(3)__________________属于维生素;
(4)___________________属于无机盐
 19.(2分)现在有100g10%的氯化钙溶液,欲将其溶质的质量分数增大到20%,可蒸发掉水
19.(2分)现在有100g10%的氯化钙溶液,欲将其溶质的质量分数增大到20%,可蒸发掉水
g,增加氯化钙 g。
20.(5分)如图小试管中盛有几毫升水,与大试管连通的
U型细玻璃管内有少量的水(已染成红色)。沿小试管壁小
心加入几小块生石灰,静置片刻后,U型细玻璃管中可观察
到 (填左或右)边的液面升高,理由是 ,
加入 也可以观察到同样的现象,不另加试剂,
用 的方法依然可以观察到同样的现象;如果加入的是硝酸铵,则观察到U型细玻璃管 (填左
或右)边的液面升高。
四.分析说明题(本大题包括4小题,每空1分,共10分)
21(2分) 铁、铜、铝三种金属是我们日常生活中非常熟悉的金属,铁的应用比铝和铜更为广泛些,请你说出铁比铝和铜应用更广的理由(要求说出二点)
① ② 。
 22.(4分) 甲、乙两位同学做了如图的实验,它们分别在
22.(4分) 甲、乙两位同学做了如图的实验,它们分别在
杯子的底部放入一种固体X,然后分别加入液体Y
(1)甲生推测实验中能够观察到的现象是蜡烛燃烧的更旺,
则甲生用的固体x可能是 ,液体y可能是 。
(2)乙生推测实验中能够观察到的现象是蜡烛熄灭,则乙
生用的固体x可能是 液体y可能是 。
23.(3分) 铁粉和硫粉以适当的质量比均匀混合,堆放在石棉网上,然后用烧红的玻璃棒一端,接触该物质,这时部分物质迅速变成红热状态,撤离玻璃棒后,反应继续剧烈进行,直至全部混合物是红热状态,冷却后得到黑色固体化合物——硫化亚铁。根据以上实验回答:
(1)铁跟硫的反应是 (填“吸热”或“放热”)反应。
(2)有关化学方程式是 。
(3)证实铁已从单质变成化合物的方法是
24.(1分)食品保鲜可以防止食品腐坏,保持食品的营养和味道。食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧保鲜剂等。某脱氧保鲜剂主要成分为活性铁粉,利用铁与氧气、水分反应生成氢氧化铁,来吸收包装袋中的氧气,从而延长食品的保质期。该反应的化学方程式为 。
五.实验探究题(本大题包括5小题,每空1分,共25分)
25.(1分) 用右图来制取气体,应满足下列条件中的: (填序号) ① 反应物都是固体
 ② 反应需要加热
② 反应需要加热
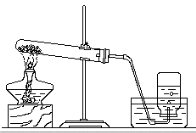 ③ 制得的气体不易溶于水
③ 制得的气体不易溶于水
④ 制得的气体密度比空气大
26.(6分)右图是收集和干燥某气体并对它吸收处理的正确
装置,请根据图回答:

①仪器名称a b c
②该气体具备的物理性质,密度 (填大于或
小于)空气,在水中的溶解性 (填易溶或难溶)
③在干燥管内放的固体物质,必须具备的基本性质
是 。
27.(8分)艳艳一直想用化学方法区别稀盐酸和稀硫酸,有一次在查阅资料时,看到了溶解性表,茅塞顿开,她根据溶解性表选取了合适的试剂,准确的将稀盐酸和稀硫酸区分开了。相信你也能象艳艳一样,阅读完溶解性表,找到区别稀盐酸和稀硫酸的化学方法,填好实验报告。
| Cl- | NO3- | SO42- |
Ba2+ | 溶 | 溶 | 不(白) |
Ag+ | 不(白) | 溶 | 微(白) |
选用的试剂 | 实验现象 | 结论和化学方程式 |
若现在实验室里有硝酸银溶液和硝酸钡溶液,那么该选用 溶液,理由是 。 | 其中之一 , 另一溶液中有 出现。 | 是稀盐酸, 是稀硫酸。 发生反应的化学方程式为 , 属于 反应 |
28.(5分)氨气(NH3)在通常状况下是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,水溶液称为氨水,在加热和有催化剂存在的条件下,氨气能跟氧气起反应生成一氧化碳和水。在常温下氨气还能跟酸、氯化钙和硫酸铜起反应。实验室常用氯化铵和熟石灰两种固体的混合物来制取氨气。
⑴实验室制取氨气 (填能或不能)选择25题
气体的发生装置,收集氨气可用 收集。
⑵若要制得干燥的氨气,可用 做干燥剂。
⑶写出氨气与氧气反应的化学方程式:
。
⑷将氨气溶于水制成氨水,应选用上述装置中的 (填序号)。
29. (5分)下面是测定空气中氧气的含量的两个实验:
实验1:在集气瓶内预先装少量水,余下的容积5等份,做好标记。在带橡皮塞和导管的燃烧匙内装足量的红磷,用弹簧夹夹紧乳胶管,点燃燃烧匙内的红磷,立即伸入集气瓶内,塞紧瓶塞(如图A所示)。
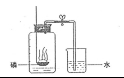

图A 图B
实验2:将试管的容积分为5等份,做好标记。在试管中加入一小块(足量)白磷,用橡皮塞塞紧试管口,将试管放入热水中,使白磷燃烧。待白磷熄灭并冷却到室温后,将试管倒立于盛有水(水的温度为室温)的水槽中(如图B),并在水中将橡皮塞取下。
⑴写出红磷燃烧的化学方程式: 。
⑵实验2中,在水中而不在空气中取下橡皮塞的原因是 。
⑶从测定结果分析,上述实验中效果较好的是 (填实验1或实验2),写出另一个实验的两点不足① ② 。
六.计算题(本大题包括2小题,共10分)
30.(5分) 液晶是一类新型材料,广泛用于电子,仪表产品等。MBBA是一种研究较多的液晶材料 其化学式为C18H21NO
⑴MBBA的相对分子质量为 ,MBBA中含有 种元素,一个MBBA分子中含有 个原子。
⑵MBBA中C、H、N、O的质量比为 。
⑶MBBA中C的质量分数是 。
31.(5分)有铜锌混合物10g,分四次向其中加入稀硫酸,每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下:
加入稀硫酸的质量/g | 第一次 | 第二次 | 第三次 | 第四次 |
10 | 10 | 10 | 10 | |
剩余固体的质量/g | 8.4 | 6.8 | 5.2 | 5.2 |
求:1、第二次实验数据说明了 。
2、通过第 次数据得知第 次加入稀硫酸后恰好完全反应。此时所得溶液中溶质的质量分数是多少?(计算结果保留小数点后一位)
2018年常德中考化学冲刺试题参考答案
1B 2A 3D 4D 5C 6C 7D 8B 9A 10D 11A发生装置相同 12B咖啡 13C二氧化碳 14A瓶底没有放少量的水或细沙 15C该元素的原子核内有11个质子 16⑴①CO2 ②HCl ③Ca(OH)2 ④CaCO3 ⑤CaO ⑥H2O ⑦CH4 ⑵①CaO+H2O=Ca(OH)2
![]()
②HCO = H2O+CO2↑ ③2HCl+Ca(OH)2=CaCl2+2H2O 17⑴碘元素 ⑵+5 57.5% ⑶混合物
18⑴鸡蛋 ⑵食用植物油 ⑶维生素D ⑷焦亚硫酸钠 19 50 12.5 20右 生石灰与水反应会放热,试管内的气体体积膨胀 浓硫酸 手握住试管外壁 左 21人们需铁量比铜、铝的更大 制取成本更低 22⑴MnO2 H2O ⑵Na2CO3 HCl 23⑴放热 ⑵Fe+S![]() FeS
FeS
24 4Fe+3O2+6H2O=4Fe(OH)3 25①②③ 26①集气瓶 漏斗 烧杯
27硝酸钡溶液 现象明显,对比强烈 无现象 有白色沉淀出现 没现象的原溶液 有白色沉淀出现的原溶液是
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 复分解反应
28⑴能 向下排空气法 ⑵氢氧化纳或碱石灰 ⑶4NH2+5O2![]() 4NO+6H2O ⑷A
4NO+6H2O ⑷A
29 ⑴4P+5O2![]() 2P2O5 ⑵防止空气进入试管,使测定结果偏低 ⑶实验2较好;在实验1中,①点燃红磷后伸入集气瓶时,会排出瓶内少量空气;②实验结束后导管内的水不能全部进入集气瓶中。
2P2O5 ⑵防止空气进入试管,使测定结果偏低 ⑶实验2较好;在实验1中,①点燃红磷后伸入集气瓶时,会排出瓶内少量空气;②实验结束后导管内的水不能全部进入集气瓶中。
30⑴267 4 41 ⑵216∶21∶14∶16 ⑶80.9%
31. 1、10g稀硫酸与1.6g锌恰好完全反应。
2、四,三,
解:设恰好完全反应后生成硫酸锌的质量为x,同时生成氢气的质量为y。
Zn + H2SO4 = ZnSO4 + H2 ↑
65 161 2
(10-5.2)g x y
65∶161=(10-5.2)g∶x
65∶2=(10-5.2)g∶y
得 x=11.9g y=0.1g
则所得硫酸锌溶液中溶质的质量分数为:![]()
答:所得溶液中溶质的质量分数为34.3%

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...