此试题可能存在乱码情况,在查看时请点击右上角全屏查看
2018年新乡中考化学模拟试题
相对原子质量:H-1 C-12 O-16 Na![]() -23 Mg-24 Cl-35.5 Ca-40 Fe-56
-23 Mg-24 Cl-35.5 Ca-40 Fe-56
一、选择题(本题包括12个小题,每小题1分,共12分)
下列各题,每题只有一个选项符合题意,请将正确选项的标号填入题后括号内。
1.下列能量的转化和使用过![]() 程中,属于化学变化的是 ( )
程中,属于化学变化的是 ( )
A.利用水流水力发电 B.利用煤火力发电
C.利用电使电炉发光发热 D.利用太阳能热水器提供热水
2.紫薯因富含硒元素被誉为“抗癌大王”。硒元素的部分息如图所示。下列说法正确的是( )

A.硒是一种金属元素
B.硒元素的中子数为34
C.硒的原子结构示意图中x=18
D.化学反应中,硒原子容易失去2个电子
3.下列各组物质按单质、化合物、混合物的顺序排列的是 ( )
A.氢气、生理盐水、稀有气体 B.液氧、冰水混合物、纯净的食盐水
C.二氧化碳、氡气、加碘食盐 D.铁丝、纯碱、消石灰
4.有关实验现象的描述错误的是 ( )
A.硫在空气中燃烧发出淡蓝色火焰
B.镁在空气中燃烧:发出耀眼白光,放出热量,产生大量的白雾
C.把盛有浓盐酸的试剂瓶的盖子打开后,瓶口上方会出现白雾
D.向硫酸铜溶液中滴加氢氧化钠溶液产生蓝色沉淀
5.下列说法正确的是 ( )
A.金刚石和不锈钢都属于合金
B.碳酸氢铵(NH4 HCO3)和硝酸钾(KNO3)均属于复合肥料
C.水结冰后分子停止运动
D.风能、太阳能属于绿色能源
6.下列各组物质在溶液中能大量共存的一组是 ( )
A. Na2CO3、NaHCO3、HCI B. NaCI、AgNO3、HNO3
C. KNO3、KCl、NaOH D. NaOH、BaCI2、H2 SO4
7.右图是某个化学反应的微观模拟图,下列关于该反应前、后的说法正确的是 ( )
A.均为混合物 B.质量减少
C.原子总数减少 D.分子总数不变
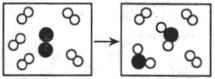
反应前反应后
8.下列除去杂质所选择试剂错误的是 ( )
选项 | 物质 | 杂质 | 所选试剂 |
A | CO2 | 水蒸气 | 浓硫酸 |
B | CACl2溶液 | 盐酸 | CaCO3 |
C | CU | CuO | 稀盐酸 |
D | NaCl溶液 | NaOH溶液 | BaCl2溶液 |
9.下列转化不能一步实现的是 ( )
A. CO→CO2 B. H2O→H2 C.Ca (OH)2→NaOH D. KNO3→KCl
10.在一个密闭容器内有a、b、c、d四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法不正确的是 ( )
| a | b | c | d |
反应前质量(g) | 8 | 10 | 10 | 2 |
反应后质量(g) | 待测 | 21 | 2 | 2 |
A.该反应可能是化合反应 B.表中待测值应为5
C.物质a与b变化的质量比为3:8 D.物质d可能是该反应的催化剂
11.下列实验操作中,正确的是
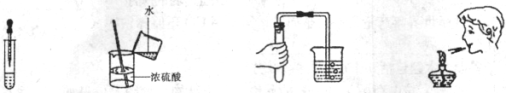
A.滴加液体 B.稀释浓硫酸 C.检查气密性 D.熄灭酒精灯
12.相同质量的Mg、Fe分别与足量稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是 ( )
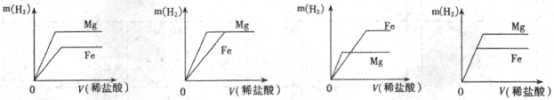
A B C D
二、填空题{本题包括6个小题,每空1分,共16分)
13.请用化学符号填空:
![]() 3
3![]() 个氮分子_____________;形成酸雨的主要气体_____________。
个氮分子_____________;形成酸雨的主要气体_____________。
14.化学物质与人体健康密切相关。馒头、米饭中富含的营养素是___________;为了预防佝偻病,青少年每日必须摄人足够量的____________元素。
15.(2分)火药是中国的“四大发明”之一![]() ,黑火药在发生爆炸时,发生
,黑火药在发生爆炸时,发生![]() 如下的反应:2KNO3+3C+S=K2S+X↑+3CO2↑。其中X的化学式为___________,在此反应中可做复合肥的物质是_____________。
如下的反应:2KNO3+3C+S=K2S+X↑+3CO2↑。其中X的化学式为___________,在此反应中可做复合肥的物质是_____________。
16.(1)用NaCI配制100mL0.9%医用的生理盐水(密度约为1 g/cm3),需要NaCl的质量为____________________g。
(2)由右图可知,t1℃时,硝酸钾溶解度____氯化钠的溶解度(填“>”,“<”或“=”);从氯化钠和硝酸钾饱和溶液中提取硝酸钾,应采用下列方法中的____________(填写编号)。
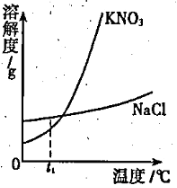
a.冷却结晶 b.蒸发溶剂c.过滤
17.A—G均为初中化学中常见的物质其中A、C组成元素相同,E是红色单质:如图是它们之间的转化关系,请回答:
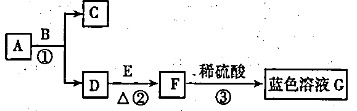
(1)反应①的化学方程式为________________________;
(2)反应②中的现象为__________________________;
(3)蓝色G溶液中溶质的化学式是________________。
18.生活离不开金属。
(1)冬天常用的“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠和水等,其发热原理是利用铁生锈时放热。发热剂需与空气中_____________接触才会发热。
(2)已![]() 知下列各组物质问均能发生置换反应。
知下列各组物质问均能发生置换反应。
A Fe和CuSO4溶液B Mg和MnSO4溶液C Mn和FeSO4溶液
出Fe和CuS04溶液反应的化学方程式______________;
②Mn、Fe、Mg、Cu四种金属的活动性白强到弱的顺序_________________;
(3)铁是世界年产量最高的金属,请写出用CO还原赤铁矿(主要成分Fe2 O3)炼铁的化学方程式__________________。
三、简答题(本题包括4个小题,共12分)
19.(3分)核电荷数为1- 18的元素的原子结构示意图等信息如下,回答下列问题:
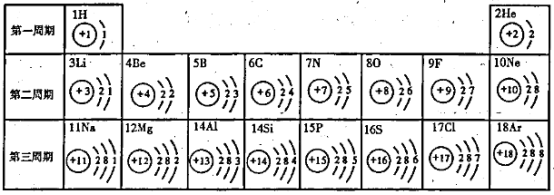 (1)在同一纵行中,各原子结构的共同之处是什么?(第八
(1)在同一纵行中,各原子结构的共同之处是什么?(第八![]() 纵行除外)
纵行除外)
(2)在第三周期中,各原子结构的共同之处是什么?
(3)写出原子序数为8、13两种元素形成化合物的化学式。
20.(3分)用化学方程式表示下列反应原理。
(1)生活中用天然气作燃料
(2)用含Mg (OH)z的药物治疗胃酸过多。
(3)燃烧含硫的烟花爆竹时,产生一种有刺激性气味的气体
21.(3分)现有A、B、c、D四种无色溶液,分别是稀盐酸、碳酸钠溶液、石灰水、氢氧化钠溶液中的一种,为了鉴别它们进行如下实验:①取四种溶液分别滴加酚酞试液,只有A中无色其它均为红色;②将A滴A余下的三种溶液中,只有B中出现气泡。回答下列问题:
(1)氢氧化钠固体的俗名是什么?
(2)请写出A与B反应出现气泡的化学方程式。
(3)用B物质可将余下的两种溶液鉴别开,写出鉴别时反应的化学方程式。
22.(3分)某同学对硫酸的一些性质进行探究,如图所示,锥形瓶内![]() 的小试管
的小试管![]() 中盛装饱和的澄清石灰水。
中盛装饱和的澄清石灰水。
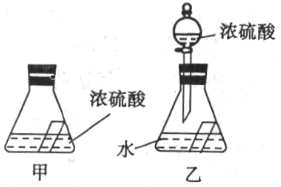
(1)甲装置放置一段时间后,澄清的石灰水出现浑浊,为什么会出现这种现象?
(2)把乙装置分液漏斗中的浓硫酸滴入水中,发现澄清石灰水也出现浑浊,请写出出现此现象的原因。(写两点)
四、综合应用题(共10分)
23.钠的化合物在日常生活中有着广泛的应用。
(1)根据生活经验推测,汗水中产生咸昧的物质可能是___________,该物质是由___________(填“原子”、“分于”、“离子”)构成的;
(2)碳酸氢钠是发酵粉的有效成分,碳酸氢钠与稀盐酸反应的化学方程式为:______________;
(3![]() )盛放氢氧化钠的试剂瓶若密封不严会使氢氧化钠发生变质。氢氧化钠变质的原因是(用化学方程式表示)________________;
)盛放氢氧化钠的试剂瓶若密封不严会使氢氧化钠发生变质。氢氧化钠变质的原因是(用化学方程式表示)________________;
(4)某无色溶液可能由氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成。为探究其组成,小华同学进行了如下实验:取适量样品放人试管中,滴加酚酞溶液,溶液变成红色![]() 。再向试管中逐滴加入过量氯化钙溶液,观察到有沉淀产生,过滤后滤液仍为红色。由实验现象可推断出样品中一
。再向试管中逐滴加入过量氯化钙溶液,观察到有沉淀产生,过滤后滤液仍为红色。由实验现象可推断出样品中一![]() 定含有的物质,是_______________(写化学式),可能含有的物质是_________________(写化学式)。
定含有的物质,是_______________(写化学式),可能含有的物质是_________________(写化学式)。
(5)向氢氧化钠溶液中不断滴入盐酸,得到如图曲线,点时溶液中的溶质是___________________________。
(6)食用纯碱中常含有少量的氯化钠。现取某食用纯碱样品10g,加入一定量稀盐酸溶液恰好完全反应,同时产生了3![]() . 3g气体。试计算该食用纯碱中Na2 CO3的质量分数(写出计算过程)。
. 3g气体。试计算该食用纯碱中Na2 CO3的质量分数(写出计算过程)。

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...