各位同学在查看时请点击全屏查看
2017年随州中考化学试题
8.成语是中华传统文化的瑰宝。下列成语中包含化学变化的是
A.刻舟求剑B.滴水石穿 C.投鞭断流 D.钻木取火
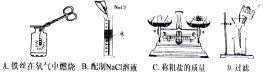
9.下列实验操作.正确的是
10.稀土是储量较少的一类金属的统称,有“工业维生素”的美誉,是不可再生的战略资源。铈是一种稀土元素,它在元素周期表中的信息如右图所示,下列有关说法错误的是

A.铈原子的核内质子数是58B.在化学反应中,铈原子一般失去电子
C.铈的相对原子质量是140.1g D.铈元素符号是Ce
11.如图,是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
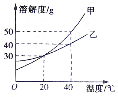
A. 20℃时,甲、乙两种固体物质的溶解度都是30
B. 40℃时,甲的饱和溶液中溶质质量分数为50%
C. 40℃时,将50g乙物质全部溶于水中,恰好能得到150g乙的饱和溶液
D.将130g 20℃甲的饱和溶液升温到40℃,最多还能溶解甲物质20g
12. “珍爱生命,远离毒品”。冰毒是一种毒品,能引发急性心脑疾病,并出现狂躁、暴力、自杀等倾向,其主要成分为甲基苯丙胺(化学式为C10H15N)。下列有关甲基苯丙胺的说法正确的是
A.相对分子质量是82 B.碳、氢、氮三种元素的质量比为10:15:l
C.是由C、H、N三种元素组成的有机物 D.充分燃烧只生成二氧化碳和水
13.归纳推理是一种重要的化学思维方法。下列归纳推理正确的是
A.碱溶液能使酚酞溶液变红,那么能使酚酞溶液变红的溶液一定是碱溶液
B.镁、锌、铁能与盐酸反应生成氢气,那么它们与稀硫酸反应也能生成氢气
C.中和反应生成盐和水,那么生成盐和水的反应一定是中和反应
D.人体缺少必需微量元素会得病,那么应尽可能多吃含有这些元素的营养品
14. 2017年6月1日,特朗普宣布美国退出《巴黎协定》,引起国际社会强烈反响,使能源和环境问题再次成为热点。下列观点或做法完全正确的是
A.保护空气 | B.爱护水资源 |
a.禁燃烟花爆竹——降低PM2.5 b.CO2增多——酸雨 c.SO2排放——温室效应 | a.用淘米水浇花——节约用水 b.活性炭——除白来水异味 c.污水处理——防止水污染 |
C.垃圾处理 | D. 能源利用 |
a.焚烧垃圾——减少“白色污染”, 环保 b.回收废电池——保护土壤 c.禁烧秸秆——减轻雾霾 | a.发现大量可燃冰——无能源危机 b.太阳能路灯——节能环保 c.车用乙醇汽油——无尾气污染 |
15.大数据能及时获得更多的信息。下列图像能正确反映对应变化关系的是

35.(6分)从H、C、N、O、Na、S、K七种元素中,选取有关的元素,用适当化学用语填空:
(l)不含电子的离子_______;(2)空气中含量最多的气体单质_______;
(3)含有10个电子的分子_______;(4)纯碱中金属元素的化合价_______;
(5)可作复合肥的盐_______; (6)生成物都是单质的分解反应_______。
36.(4分)留心观察,化学就在身边:
(1)某班同学给学校食堂提出的下列建议中不合理的是_______(填字母,下同)
A.多提供油炸食品 B.常提供水果 C.提供一次性餐具 D.常供应粗粮
(2)加油站、面粉加工厂应张贴下列标志中的_______;

(3)测量体温时,体温计汞柱上升的微观原因是________;
(4)小明同学刚做完CO2的性质实验后,用烧杯罩住两支点燃的、高矮不同的蜡烛(如图),竟看到了高蜡烛先熄灭的现象,请你帮他解释_________。

37.(3分)将一定量的金属M(M是Mg、Al、Zn、Fe中的一种)粉末放入AgNO3和Cu(NO3)2的混合溶液中,充分反应后过滤,得到滤渣和无色滤液。向滤渣和滤液中分别滴加稀盐酸均无明显现象产生。
(1)金属M不可能是_______(填名称)。
(2)滤渣中一定含有的金属是_______;无色滤液中含有的阴离子是_______(填符号)。
38.(4分)小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置如图
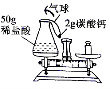
(1)根据实验目的,小李必须测量的数据是______。
A.锥形瓶质量
B.气球质量
C.反应前整个反应装置(包括里边的物质)质量
D.反应后整个反应装置(包括里边的物质)质量
(2)将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因_。
(3)反应结束后,锥形瓶中无固体剩余,则生成气体质量____g,所得溶液中生成物的溶质质量分数(只需写出最终的计算表达式)_____。
39.(4分)一定条件下,甲、乙、丙、丁四种常见物质有如下关系:甲+乙→丙+丁。
(1)若甲、丙是单质,乙、丁是化合物,且甲乙均为黑色粉末,该反应的基本类型是____,反应结束后,固体质量______(填“增加”“减少”“不变”或“无法确定”)。
(2)若甲、乙、丙、丁都是化合物,且丙是蓝色沉淀,则丁属于_____(填“酸”、“碱”、“盐”或“氧化物”),写出一个符合这一条件的化学反应方程式_________。
40.(4分)根据图中装置回答问题:
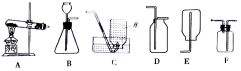
(l)实验室选用A装置制取氧气的化学方程式__________。
(2)硫化氢(H2S)气体是一种密度比空气大,能溶于水的有毒物质,其水溶液叫氢硫酸。实验室常用硫化亚铁(FeS)固体和稀硫酸在常温下发生反应制取硫化氢气体,应选择的发生装置是_______。小虹同学认为收集硫化氢气体可用D或F装置,但小娟提出了质疑,小娟的理由是__________。写出你改进后收集方法:_______________。
41.(9分)实验探究一:课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ① 产生的气体是______ ② 红砖粉末能改变过氧化氢分解速率 |
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ① 又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的_____在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡且______ | 红砖粉末的催化效果没有二氧化锰粉末好 |
【拓展应用】www.ccutu.com
己知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气_____g。
实验探究二:实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。淅河中学化学学习小组发现一瓶未密封的氢氧化钾固体,对其是否变质进行探究。
【提出猜想】1.未变质 2.部分变质 3.完全变质
【查阅资料】KOH与NaOH性质类似,也能与CO2反应而变质。写出KOH变质的化学方程式为_____。
【设计实验】
(l)取少量样品于试管中配成溶液,滴加足量稀盐酸有气泡产生,则猜想_____不成立。
(2)准确称取一定质量的固体样品,放在右图所示装置中进行实验,根据CO2的体积和密度计算变质产物的质量,从而确定变质情况,你认为这个方案是否可行,并说明理由_________。
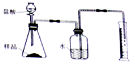
(3)请你另外设计一个方案,进一步探究变质情况
实验步骤 | 实验现象 | 实验结论 |
|
| 猜想2成立 |
2017年随州中考化学试题参考答案
一、2017年随州中考化学试题参考答案选择题(每小题2 分,共16 分)
8.D 9.A l0.C 11.D 12.C 13.B 14.B 15.A
二、2017年随州中考化学试题参考答案非选择题(每空1分,共34分)
35.(6分)(1)H+;(2)N2;(3)CH4或NH3或H2O(任写一种即可)
(4)+1;(5)KNO3;(6)2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
36.(4分)(l)AC(只选对l个得0.5分,错选不得分)(2) C
(3)温度过高,原子间隔增大;(4)燃烧放热使生成的CO2气体密度比空气小,浮在上面
37.(3分)(1)铁(2)Cu、Ag(只填一种不得分); NO3-
38.(4分)(l) C D (只填1个不得分);
(2)气球膨胀受到浮力增大(或装置漏气);
(3)0.88g;![]() 。
。
39.(4分)(1)置换反应:减少;
(2)盐:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
40.(4分)(1)2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(2)B;H2S气体有毒会污染空气;用F装置收集,排出的气体用塑料袋收集(或通入碱溶液或水中)。
41.(9分)探究一(4分):
实验步骤 | 实验现象 | 实验结论及解释 |
|
| ①氧气 |
|
| 化学性质和质量 |
| C中产生气泡较慢 |
|
【拓展应用】3.2g
探究二(5分):
【查阅资料】2KOH+CO2=K2CO3+H2O
【设计实验】(l)l
(2)不可行,因为CO2能溶余水(或与水反应),导致测量结果误差较大。
(3)
实验步骤 | 实验现象 | 实验结论 |
另取少量样品,配成溶液滴加足量CuCl2溶液,静置后滴加酚酞溶液 | 产生白色沉淀 溶液变红色 | 猜想2成立 |
(说明:设计思路为先除尽CO32-,然后证明OH-存在。合理即可)
![]()

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...