此试题可能存在乱码情况,在查看时请点击右上角全屏查看
2018年岳阳中考化学复习题
温馨提示:
1.本试卷共四大题,24小题,满分100分,考试时量60分钟;
2.本试卷分为试题卷和答题卡,所有答案都必须填涂或填写在答题卡规定的答题区域内;
3.考试结束,考生不得将试题卷、答题卡、草稿纸带出考场。
4.可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5
一、选择题(每小题只有一个选项符合题意。本题共15道小题,每小题3分,共45分)
1.下列各生活现象中,涉及化学变化的是
A.粗盐潮解 B.水果腐烂 C.蔗糖溶解 D.酒精挥发
2.空气成分中体积分数约为21%的是
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
3.生活离不开化学,下列做法合理的是
A.用甲醛处理海产品,延长保质期 B.焚烧废弃塑料以减少“白色污染”
C.大量使用化肥以提高农作物产量 D.炒菜时油锅着火,立即盖上锅盖
4.某物质经分析知道只含有一种元素,则该物质不可能是
A.混合物 B.纯净物 C.化合物 D.单质
5.下列有关实验现象的描述正确的是
A.铵态氮肥加碱研磨放出有刺激性气味的氨气
B.打开盛浓盐酸试剂瓶的瓶盖时,瓶口冒白烟
C.硫在空气中燃烧时,发出微弱的淡蓝色火焰
D.铁锈与稀盐酸反应,溶液由无色变成浅绿色
6.下列现象的微观解释中,正确的是
A.“墙内开花墙外香”——分子在不停地运动
B.水烧开后易把壶盖冲起——温度升高,分子变大
C.气体比固体易压缩——气态时分子间有间隔,固态时没有
D.电解水时,产生氧气和氢气——水中含有氧分子和氢分子
7.下列生活中常见物质的溶液能使酚酞溶液变红的是
A.食盐 B.苏打 C.可乐 D.蔗糖
8.下列物质中,氮元素的化合价为+4价的是
A.N2 B.NH3 C.NO2 D.KNO3
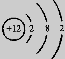 9.下列是几种粒子的结构示意图,有关说法正确的是
9.下列是几种粒子的结构示意图,有关说法正确的是
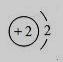
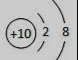
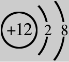
① ② ③ ④
A.①和④两种粒子的化学性质相似 B.②和③表示的粒子均为离子
C.③和④属于同种元素的不同粒子 D.③表示的粒子的符号为Mg+2
10.交警通常用一种“酒精检测仪”检查司机呼出的气体中的酒精含量是否超标,其反应原理为:C2H5OH+4CrO3+6H2SO4==2X+2CO2↑+9H2O , 反应中红色的CrO3转变为绿色的化合物X。则X的化学式应为
A.Cr2O3 B.CrSO3 C.Cr2(SO4)3 D.CrS
11.绿色生态宜居新城区,是雄安新区的一个重要功能定位。若对新区的市民和单位提出下列要求,其中不合理的是
A.污水集中处理 B.禁止燃放烟花炮竹
C.垃圾分类处理 D.禁止使用化石燃料
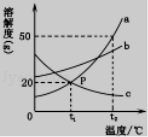
12.如图是a,b,c三种物质的溶解度曲线,下列分析不正确的是
A.t2℃时,a,b,c三种物质的溶解度由大到小的
顺序是a>b>c
B.t2℃时,将50g a物质放入100g水中充分溶解得
到a的饱和溶液
C.t1℃时 a,b,c三种物质的溶液中溶质质量分数
关系是b>a=c
D.除去a中少量的c,可采用降温结晶的方法
13.用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液。下列说法中,正确的是
![]()
![]()
![]()
![]()
![]()
① ② ③ ④ ⑤
A.甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B.甲实验各步操作中,玻璃棒的作用都是相同的
C.乙实验中,若按步骤②③①进行操作,则配制的溶液浓度偏大
D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
14.某河道两旁有甲乙两厂。它们排放的污水各含有下列离子H+、Cu2+、K+、NO3-、OH-中的三种离子(两厂只含有一种相同的离子)。若将两厂的污水按一定比例混合,沉淀后污水会变成无色澄清的中性溶液。下列关于污水的分析,不正确的是
A.Cu2+和OH-不可能来自同一工厂 B.Cu2+和 K+ 可能来自同一工厂
C.H+ 和OH- 不可能来自同一工厂 D.NO3-和OH- 可能来自同一工厂
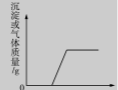
15.下列实验中相关量的关系不能用右图表示的是
A.加热氯酸钾和二氧化锰的混合物,产生的氧气与时间的关系
B.硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液至过量,生成的沉淀与加入氢氧化钠溶液的质量关系
C.氢氧化钠和碳酸钠的混合溶液中滴加盐酸,产生气体与所加盐酸的关系
D.硫酸和盐酸的混合溶液中滴加氯化钡溶液,生成的沉淀与加入氯化钡的质量关系
二、填空与简答题(本题共5道小题,每空2分,共32分)
16.用正确的化学符号填空:
(1) 3个铵根离子 ; (2)二氧化硫中硫元素的化合价 。
17.请从下列物质中,选择适当的物质填空(填序号):
①石墨 ②干冰 ③尿素 ④明矾 ⑤硝酸钾 ⑥肥皂水
(1)可用于人工降雨的是
(2)可用于区分硬水和软水的是 ;
(3)小敏家的油菜茎秆细弱,为防止大面积倒伏,应追加的化肥是 。
18.家庭厨房实际上就是一个化学世界:柴、米、油、盐、醋等都是化学物质。请根据你所掌握的化学知识,结合厨房中的常用物质,回答下列问题:
(1)“柴”:天燃气的主要成分是______(填化学式)。
(2)“米”:含有的营养素是______;
(3)“油”:餐具上的油污用加入洗洁精的水更易洗净,原因是________________
(4)“盐”:厨房中最重要的调味品,食盐加碘是为了预防____________________
(5)“醋”:食醋含有醋酸,醋酸具有与盐酸、稀硫酸相似的化学性质是因为:
_______________________________________。
19.金属材料在生产和生活中的应用十分广泛。
(1)生铁和钢都是铁的合金,二者性能不同的原因是 __________________ ;
(2)将一定量的锌粉放入稀硫酸、硫酸亚铁、硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加盐酸有气泡产生.则滤渣中一定含有的固体的化学式是____ _________;滤液中一定不含的物质的名称是______________。
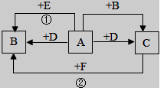
20.如图,A、B、C、D、E、F均是初中化学的常见物质,A、B、C含有同一种元素,变化①的现象是颜色由黑变红,变化②的现象是颜色由红变黑,相应变化的生成物没有全部列出,各变化的条件也未标出。回答下列问题:
(1)写出物质C的化学式: ______;
(2)写出变化①的化学方程式:________ _,该反应属于 反应(填基本反应类型)
三、实验与探究题(本题共2道小题,每空2分,共16分)
21.根据下图中所示装置回答下列问题。
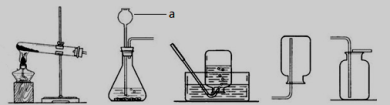
A B C D E
(1)图中仪器a的名称 ,
(2)实验室制取二氧化碳的反应化学方程式为: ,
应选用的发生装置和收集装置是 (填字母)。
(3)用高锰酸钾制取氧气时,装置A还需要做的一点改动是 。
22.小红和她的同学学习了金属活动性及稀硫酸的一些性质后,对铜与浓硫酸能否发生反应产生了兴趣,并进行了如下探究:
【提出问题】
猜想Ⅰ:铜与浓硫酸不能反应;
猜想Ⅱ:铜与浓硫酸能反应,且可能生成氢气。
【实验探究】
实验Ⅰ:在一支试管中加入一小片铜,再加入少量的浓硫酸,放置一段时间,试管中无 现象;
实验Ⅱ:再给上述试管加热,试管中产生有刺激性气味的气体,将反应后的溶液小心地注入到盛有少量水的烧杯中,溶液呈现出明显的蓝色。
【分析猜想】
(1)溶液呈蓝色,说明生成了 。
(2)根据实验现象及已有的知识推断,产生的气体不可能是氢气,很可能是一种含硫元素的气体。
【查阅资料】
(1)常见的含硫元素的气体有二氧化硫和硫化氢。
(2)二氧化硫和二氧化碳相似,都能和氢氧化钠等碱溶液反应生成盐和水。
(3)二氧化硫能使品红溶液褪色,加热,又能恢复原来的红色。硫化氢不能使品红溶液褪色。
(4)二氧化硫和硫化氢均有毒。
【实验探究】
为了检验产生的有刺激性气味的气体的成分,小红和她的同学进一步实验:将产生的气体通入品红溶液中,品红溶液褪色,加热,溶液又恢复了红色。
【实验结论】
(1)在常温下,铜与浓硫酸不能反应;
(2)在加热条件下,铜与浓硫酸反应产生的气体是 ,此反应还生成了水, 则该反应的化学方程式为: 。
【拓展延伸】
为了防止污染空气,小红和她的同学可采用 溶液来吸收多余的气体。
四、计算题(本题共2道小题,第45小题2分,每空1分;第46小题5分,共7分)
23.制造口香糖时常用木糖醇(分子式:C5H12O5)代替蔗糖。
(1)一个木糖醇分子由 个原子构成。
(2)木糖醇中碳元素的质量分数为______(结果保留至0.1%)
24.某纯碱样品中含有少量氯化钠。为测定样品中碳酸钠的质量分数,现称取该样品11g,加入到盛50g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g。计算:
(1)纯碱样品中碳酸钠的质量为 g;(2分)
(2)所用盐酸中溶质的质量分数(3分,写出详细的解题过程)。
1

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...