由于格式问题此试题可能会出现乱码的情况
为了方便您阅读请点击右上角的全屏查看
2018枣庄市中考复习化学练习题
第一部分 选择题(共25分)
(每小题只有一个选项符合题意。每小题1分)
1.下列变化中,属于化学变化的是
A.矿石粉碎 B.酒精燃烧 C.汽油挥发 D.冰雪融化
2.下列生活用品中,属于纯净物的是
A.牛奶 B.蒸馏水 C.加碘盐 D.山西陈醋
![]() 3.下列物品所使用的主要材料中,属于有机合成材料的是
3.下列物品所使用的主要材料中,属于有机合成材料的是
A.木制桌椅 B.塑料杯托 C.金属表链 D.陶瓷碗
4. (枣庄中考化学)下列食物富含糖类的是
A.鸡蛋 B.黄瓜 C.牛肉 D.米饭
5.下列物质在氧气中燃烧,产生大量白烟的是
A.红磷 B.木炭 C.甲烷 D.铁丝
6.“含氟牙膏”“加碘盐”“铁强化酱油”中的“氟”、“碘”、“铁”指的是
A.分子 B.原子 C.离子 D.元素
7.夏天的傍晚,去散步前往身上喷花露水,蚊子![]() 就不敢靠近,这一现象说明
就不敢靠近,这一现象说明
A.分子之间有间隙 B.分子在不断运动
C.分子由原子构成 D.分子的质量较大
8.下列饮品属于溶液的是
A.蔗糖水 B.牛奶 ![]() C.果粒橙 D.豆浆
C.果粒橙 D.豆浆
9.(枣庄中考化学)用分子的相关知识解释下列现象,其中正确的是
A.闻到花香——分子不断运动
B.氧气助燃,氢气可燃——分子的质量不同
C.氢气球在高空膨胀——分子体积变大
D.氢气燃烧生成水——分子间有间隔
10.(枣庄中考化学)下列标![]() 识
识![]() 中,表示禁止烟火的是
中,表示禁止烟火的是
A B C D
11.下列符号表示2个氢原子的是
A.H B.2H C.H2 D.H+
12.下列物质中含有氧分子的是
A.空气 B.二氧化碳 C.过氧化氢 D.水
13.已知![]() 一种氧原子,原子核内含有8个质子和10个中子,则该氧原子核外电子数为
一种氧原子,原子核内含有8个质子和10个中子,则该氧原子核外电子数为
A.2 B.8 C.10 ![]() D.18
D.18
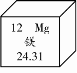 14.(枣庄中考化学)镁有“国防金属”的美誉。在元素周期表中,镁元素的信息如下图所示,对图中信息解释不正确的是
14.(枣庄中考化学)镁有“国防金属”的美誉。在元素周期表中,镁元素的信息如下图所示,对图中信息解释不正确的是
A.原子序数为12 B.元素符号为Mg
C.属于金属元素 D.相对原子质量为24.31g
15.下列物质的用途中,利用其化学性质的是
A.干冰用于人工降雨 B.石墨作铅笔芯
C.用铜丝作导线 D.用稀盐酸除去铁锈
16.新型锂离子电池的主要成分是LiFePO4,已知锂(Li)的化合价为+1价,Fe的化合价为+2,则LiFePO4中P的化合价是
A.+2 B.+3 C.+5 D.+6
17.(枣庄中考化学)某花圃所种的花卉缺乏氮元素和钾元素,如果只施用一种化肥,则应施用的是
A.K2CO3 B.KNO3 C.CO(NH2)2 D.Ca(H2PO4)2
18.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法正确的是
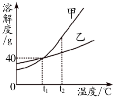 A.t1℃时,甲溶液中溶质的质量分数一定等于乙溶液
A.t1℃时,甲溶液中溶质的质量分数一定等于乙溶液
B.降低温度,可使甲的饱和溶液变为不饱和溶液
C.t2℃时,分别在100 g水中加入50 g 甲、乙,
同时降温至t1℃,甲、乙溶液均为饱和溶液
D.将t2℃时甲的饱和溶液降温至t1℃,溶液质量不变
19.(枣庄中考化学)下列有关生活、环境、资源等问题叙述不正确的是
A.pH<5.6的雨水称为酸雨
B.“温室效应”主要是由CO2等气体引起的
C.地球表面约71%被水覆盖,因此淡水资源丰富
D.PM2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性
20.下列物质的用途中,利用其化学性质的是
A.干冰用于人工降雨 ![]() B.天然气用作燃料
B.天然气用作燃料
C.氢氧化钠用作干燥剂 D.大理石用作建筑材料
21.从电解水反应的微观示意图中![]() 获得的信息正确的是
获得的信息正确的是
![]()
A.化学反应是分子的重新组合 B.化学反应前后原子的数目增多
C.该反应说明水由氢气和氧气组成 D.该反应的基本反应类型为分解反应
22.(枣庄中考化学)下列物质暴露在空气中,质量增加且变质的是
A.浓硫酸 B.浓盐酸 C.氢氧化钠 D.石灰石
23.下列各组气体中,不能用燃着的木条区分的是
A.氧气和空气 B.二氧化碳和氮气 C.甲烷和空气 D.一氧化碳和二氧化碳
24.下列做法不正确的是
A.电器失火后首先要切断电源 B.进入久未开启的地窖前先做灯火实验
C.厨房煤气泄漏后立即打开抽油烟机 D.燃放烟花爆竹时,远离人群和可燃物
25.某同学对下列四个实验都设计了两种方案,其中方案1不合理、方案2合理的是
选项 | A | B | C | D |
实验 目的 | 除去氢氧化钠中少量的碳酸钠 | 清洗铁制品 表面的铁锈 | 鉴别氯化钠 溶液和稀盐酸 | 检验一氧化碳中是否 混有二氧化碳气体 |
方案1 | 加水溶解 | 加适量稀盐酸 | 加锌粒 | 点燃 |
方案2 | 加稀硫酸 | 用水洗涤 | 加石蕊溶液 | 通入澄清石灰水 |
〖生活现象解释〗
26.(4分)从①氮气 ②氧气 ③生石灰 ④熟石灰 ⑤碳酸氢钠 ⑥碳酸钙6种物质中选择适当的物质填空。
(1)可用作焊接金属的保护气的是 。
(2)可用作补钙剂,其补钙原理是 (用化学方程式表示)。
(3)可用作食品干燥剂的是 。
(4)制作松软可口的馒头时常加入发酵粉,其主要成分是 。
27.((枣庄中考化学)4分)想要做出绿色的包子。
(1)可将菠菜榨汁,通过 操作将菜渣去除,用菜汁和面。
(2)发面过程中需要加入碳酸氢钠,碳酸氢钠俗称 ,碳酸氢钠还可用于治疗胃酸过
多,其原理是 (用化学方程式表示)。
(3)调馅时使用铁强化酱油,人体“补铁”可以预防_______(填序号)。
A.骨质疏松 B.缺铁性贫血
C.甲状腺肿大 D.营养不良
28.(3分)“绿色出行,低碳生活”是公租自行车倡导的主题。据统计,目前通州区共投入运行营15000辆自行车。![]() 三年来累计办卡10万张,节能减排逾亿吨。
三年来累计办卡10万张,节能减排逾亿吨。
(1)右图自行车所标示的各部件中,属于有机合成材料的是_______(填序号)。
(2)公共自行车的闸线是钢丝,由钢锭制
成钢丝说明金属材料具有_______性。
(3)车架表面喷漆防锈蚀的原理是_______。
29.(枣庄中考化学)(4分)水是我们每天都需要的物质。
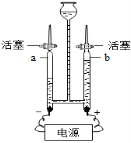 (1)右图是实验室电解水实验的装置图,反应的化学方程式为 ,
(1)右图是实验室电解水实验的装置图,反应的化学方程式为 ,
a试管中产生的气体为 。
自然界中的水需净化后饮用,活性炭常用于净化水,其主要
作用是 。
(3)水常用于灭火,其灭火原理是 。
30.(5分)金属和金属材料在生活中有广泛用途。
(1)高铁列车的开通,使人们的出行更加方便、快捷。
①列车电路中的导线大多是用铜制的,这是利用了铜的延展性和 性。
 ②列车车体使用的金属材料是用一氧化碳还原赤铁矿炼制的,其反应的化学方程式为 。
②列车车体使用的金属材料是用一氧化碳还原赤铁矿炼制的,其反应的化学方程式为 。
车体表面喷漆除美观外,主要是为了防止外壳生锈,其防锈原理是 。
③铝热剂是修建铁路时常用的焊接材料,其反应原理
是在高温下,铝与四氧化三铁反应得到熔融的铁与一种氧
化物,该反应的化学方程式为 。
(2)已知M、N、R三种金属存在如下反应:R+NCl2= N+ RCl2 ,M+ RCl2 = R + MCl2,则M、N 、R三种金属的活动性由强到弱的顺序为 。
31.(枣庄中考化学)(5分)生活中常用的清洗剂。
名称 | 洁厕灵 | 炉具清洁剂 | 高效去污粉 | 消毒液 |
产品 样式 |
|
|
|
|
有效成分 | 盐酸 | 氢氧化钠 | 碳酸钠 | NaCl和NaClO |
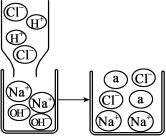 (1)若将洁厕灵与炉具清洁剂混合,可以发生右图所示的化学反应。
(1)若将洁厕灵与炉具清洁剂混合,可以发生右图所示的化学反应。
该反应的化学方程式为 , 图中a微粒的微观示意图为 。
(2)高效去污粉中加入足量的洁厕灵,发生反应的化学方程式为 。
(3)消毒液成分中, 中 Cl元素的化合价为+1价。工业上将氯气(Cl2)通入烧碱溶液中可制取消毒液,该反应的化学方程式为 。
〖科普阅读理解〗
32. (枣庄中考化学)(5分)阅读下面科普短文。
锂电池是指电极材料含金属锂或含锂化合物,使用非水溶液做离子导体的电池。银白色的金属锂是所有金属中最轻的一种,它的化学性质活泼,常温下就能和空气中的氧气化合成氧化锂;锂还能和水剧烈反应变成氢氧化锂(LiOH),同时放出一种可燃性气体。
![]() 最早出现的锂电池利用化学反应Li+MnO2
最早出现的锂电池利用化学反应Li+MnO2 ![]() LiMnO2提供电能。随着科技的发展,锂电池的应用范围逐步扩大,一类新型锂电池——锂离子电池大量应用在手机、笔记本电脑和家用小电器上。锂离子电池由正极、负极、隔膜和电解液构成,正极材料(如石墨)和负极材料(如LiCoO2)均能传导电子,电解液在正、负两极之间起输运离子、传导电流的作用。锂离子电池采用一种类似摇椅式的工作原理,充放电过程中锂离子在正负极间来回穿梭,从一边“摇”到另一边,往复循环,实现电池的充放电过程。
LiMnO2提供电能。随着科技的发展,锂电池的应用范围逐步扩大,一类新型锂电池——锂离子电池大量应用在手机、笔记本电脑和家用小电器上。锂离子电池由正极、负极、隔膜和电解液构成,正极材料(如石墨)和负极材料(如LiCoO2)均能传导电子,电解液在正、负两极之间起输运离子、传导电流的作用。锂离子电池采用一种类似摇椅式的工作原理,充放电过程中锂离子在正负极间来回穿梭,从一边“摇”到另一边,往复循环,实现电池的充放电过程。
由于锂离子电池中包含的电解液多含有机物,普遍存在易燃问题,在过充、过放、短路及热冲击等滥用的状态下,电池温度迅速升高,常常会导致电池起火,甚至爆炸。因此,目前大多数数码产品都会配备相应的保护元件,当检测到电池到达满电状态,会自动切断充电电路。
依据文章内容,![]() 回答下列问题:
回答下列问题:
(1)金属锂的物质性质有 (答一条即可)。
(2)锂离子电池由 构成。
(3)锂离子电池负极材料为LiCoO2,其中Li为+1价,则Co的化合价为 。
(4)锂电池使用非水溶液做离子导体的原因是 (用化学方程式表示)。
(5)安全使用锂离子电池的措施有 。
33. (枣庄中考化学)(5分) 根据下图回答问题:
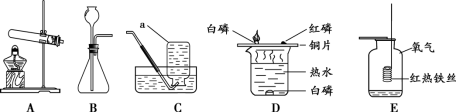
(1)仪器a的名称是__________。
(2)用 A与C连接制取气体的化学方程式为 。
(3)用C装置收集气体的依据是 ![]() 。
。
(4)D装置用来探究燃烧的条件,当观察到 时,说明可燃物燃烧温度需要达到着火点。
(5)E装置中水的作用是 。
34.(枣庄中考化学)(4分)化学小组的同学用干冰做了一组有趣的实验。
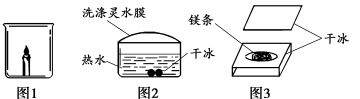
(1)将一小块干冰放入图1所示烧杯中,观察到的现象是 ,产生该现象的原因是 。
(2)将干冰放入盛有少量热水的玻璃碗中,用绳子蘸取洗涤灵水在碗口轻轻刮一层薄膜,一段时间后观察到如图2所示的现象,水膜鼓起的原因是 。
(3)在干冰中间挖一个槽,将镁条点燃放入槽内(如图3所示),在上方盖一块干冰,观察到镁条继续燃烧,有黑白相间的固体生成,该固体的成分可能是 。
〖实验原理分析〗
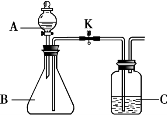 35. (枣庄中考化学)(5分)化学小组同学用下图所示装置(夹持仪器已略去)做兴趣实验。
35. (枣庄中考化学)(5分)化学小组同学用下图所示装置(夹持仪器已略去)做兴趣实验。
(1)若A中盛放足量浓氢氧化钠溶液,B中盛放二氧化碳气体,C中盛放稀盐酸。将分液漏斗中的浓氢氧化钠注入B中,此时B中发生反应的化学方程式为 ,一段时间后打开止水夹K,观察到的现象是 。
(2)若A中盛放足量的________,B中盛放蒸馏水,C中盛放某红色溶液。打开止水夹K,将A中物质滴入B中充分接触后,可观察到B中液体进入C中,C中红色溶液变成无色。C中盛放的物质可能是_____________,一段时间后可能观察到的现象是 。
〖科学探究〗
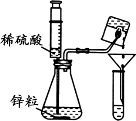 36.(枣庄中考化学)(6分)某同学在做“氢气在空气中燃烧”实验时,对生成物的成分产生了质疑:水和过氧化氢具有相同的组成元素,那么氢气在空气中燃烧除生成水外,是否还有过氧化氢生成呢?带着疑问,该同学利用如图所示实验装置进行了以下探究。
36.(枣庄中考化学)(6分)某同学在做“氢气在空气中燃烧”实验时,对生成物的成分产生了质疑:水和过氧化氢具有相同的组成元素,那么氢气在空气中燃烧除生成水外,是否还有过氧化氢生成呢?带着疑问,该同学利用如图所示实验装置进行了以下探究。
【提出猜想】氢气在空气中燃烧除生成水,还有过氧化氢生成。
【查阅资料】
①在一![]() 定条件下(低温环境下),氢气在空气中燃烧除生成水外,还有过氧化氢生成。
定条件下(低温环境下),氢气在空气中燃烧除生成水外,还有过氧化氢生成。
②过氧化氢溶液能使无色的淀粉碘化钾溶液变蓝色。
【实验探究】
主要步骤 | 主要现象 | 实验结论 |
Ⅰ.将注射器内的稀硫酸注入到盛有锌粒的锥形瓶中 | 在锌粒表面有 产生 | 反应的化学方程式为 ________________________ |
Ⅱ.点燃经验纯后的氢气,用底部结有冰的小烧杯罩在火焰上方,用漏斗和试管收集所得液体。向试管中加入 。 | 氢气燃烧产生淡蓝色火焰,试管中液体由无色变_____色 | 氢气在空气中燃烧有过氧化氢生成 |
【反思评价】实验中将氢气燃烧的火焰对着冰,冰的作用是 。
A.有利于防止生成的过氧化氢分解
B.使生成的过氧化氢溶入冰融化成的水中,便于收集
C.创设低温环境,使部分氢气燃烧产生一定量的过氧化氢
【拓展分析】(枣庄中考化学)除氢气和氧气反应会生![]() 成两种氧化物外,金属钠也具有类似的化学性质。钠露置在空气中与氧气反应生成氧化钠,钠在空气中燃烧生成过氧化钠(Na2O2)。钠在空气中燃烧的化学方程式为 。
成两种氧化物外,金属钠也具有类似的化学性质。钠露置在空气中与氧气反应生成氧化钠,钠在空气中燃烧生成过氧化钠(Na2O2)。钠在空气中燃烧的化学方程式为 。
〖实际应用定量分析〗
37.(枣庄中考化学)(7分)柠檬酸(C6H8O7)是一种常见的有机酸,用棉花蘸取柠檬酸溶液,擦洗杯子内的茶渍。
 (1)柠檬酸中碳、氢元素的质量比为 ,氧元素质量分数的计算式为 。
(1)柠檬酸中碳、氢元素的质量比为 ,氧元素质量分数的计算式为 。
(2)现配制200 g质量分数为40%的柠檬酸溶液,实验操作如下:
①称量 g柠檬酸固体;②用量筒量取 mL水(ρ水≈1 g/cm3);③溶解;④装瓶、贴标签:在右图的标签中填上相应的内容。
整个实验过程中用到的玻璃仪器有 。
(3)若将50g质量分数为40%的柠檬酸溶液,稀释成10%的柠檬酸溶液,需加水 g。
38.(3分)在质量为150 g的烧杯中加入100 g过氧化氢溶液,再向其中加入2 g二氧化锰。充分反应后,称得烧杯和剩余物质总质量![]() 为250.4 g。请通过计算判断该过氧化氢溶液中溶质的质量。
为250.4 g。请通过计算判断该过氧化氢溶液中溶质的质量。

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...