2018年江西省上饶市中考化学模拟冲刺题(精编解析版)
由于版式的问题,试题可能会出现乱码的现象,为了方便您的阅读请点击全屏查看
一.选择题
1.某同学用托盘天平称量固体物质时,把固体物质放在右盘,砝码放在左盘,称得固体物质的质量为10.8 g(1克以下用游码),如果按正确的方法称量,这位同学所称固体的实际质量是()
A.9.2 g B.9.8 g C.10.8 g D.10.2 g
2.A、B、C三种物质各15g,它们化合时只能生成30g新物质D.若增加10gA,则反应停止后,原反应物种只余C.根据上述条件推断下列说法正确的是()
A.第一次反应停止后,B剩余9g
B.第二次反应后,D的质量为40g
C.反应中A和B的质量比是3﹕2
D.反应中A和C的质量比是5﹕2
3.已知一个SO2分子的质量为n克,一个SO3分子的质量为m克,若以氧原子质量的![]() 作为相对原子质量的标准,则SO3的相对分子质量()
作为相对原子质量的标准,则SO3的相对分子质量()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
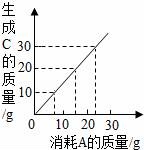
4.某反应2A+2B→2C,其中A和C有如图所示的质量关系.当有20gC生成时,消耗B的质量为(B的相对分子质量为30)()
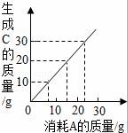
A.10g B.5g C.15g D.13g
5.氯酸钾和二氧化锰的混合物共A克,加热完全反应后得到B克氧气和C克氯化钾,则混合物中二氧化锰的质量为()
A.(A+B﹣C)克 B.(A﹣B﹣C)克 C.(A+B+C)克 D.(A+C)克
6.氢气和氧气的混合物共20g在一密闭容器内点燃,充分反应后生成18g水.则原混合物中氢气质量为()
A.2g B.4g C.2g或4g D.无法确定
二.填空题
7.(14分)用化学用语填空
(1)相对分子质量最小的氧化物:
(2)保持硫酸铜化学性质的粒子:
(3)高锰酸根离子:
(4)画出He﹣3的结构示意图:
(5)碳酸钙的化学式为
(6)岩石呈红色是含氢氧化铁所致,氢氧化铁原子团的化合价.
(7)标出KClO3中氯元素的化合价.
8.配平下列化学方程式
(1)CuFeS2+O2═CuO+Fe2O3+SO2
(2)C5H12+O2═CO2+H2O.
9.有机物的命名与它的构成规律紧密相关.如有机物甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8),按此规律,丁烷的化学式为.
10.工业盐酸常含有少量的三氯化铁,若其中H+与Cl﹣的个数比为94:97,则Fe3+与Cl﹣的个数比为.
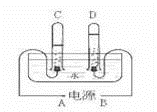
11.阿伏加德罗曾经总结出一条定律:在同温同压下,同体积的任何气体都含有相同的分子数.如图是实验室电解水的简易装置示意图.
①接通直流电源后,B电极为电源的极,C管中的气体是气
②C、D两试管内气体的体积比为.
③电解水反应的化学方程式:.
④水电解过程中,发生变化的微粒是,不发生变化的微粒是和.(均填名称)
12.将14.0g硫在一定量的氧气中燃烧,记录如下数据:
实验次数 | 1 | 2 | 3 |
氧气的质量/g | 4.5 | 14.0 | 18.0 |
二氧化硫的质量/g | 9.0 | 28.0 | 28.0 |
分析数据,回答下列问题.
(1)在这三次实验中,第次刚好完全反应.
(2)在第次实验中硫有剩余,剩余g.在第次实验中氧气有剩余,剩余g.若将剩余的硫在剩余的氧气中燃烧,可生成二氧化硫g.
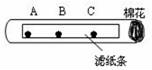
13.如图所示,在试管中的滤纸条上A、B、C三处各滴上一滴无色酚酞,再向试管口的棉花团上滴一些浓氨水.
(1)实验中,可以观察到A、B、C三处的酚酞溶液由(填A、B、C或(C、B、A)顺序先后变成色.该实验说明分子的性质是.
(2)实验中,往往在试管下放一张白纸,白纸的作用是.
三.探究题
14.某兴趣小组同学对实验室制取氧气的条件进行如下探究实验.
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比试验:
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将xg KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.
Ⅰ中反应的化学方程式是;Ⅱ中x的值为.
②乙探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2的装置是(填序号).

实验结论:在相同条件下,,双氧水分解得快.
丙用如图装置进行实验,通过比较也能达到实验目的.
2018年江西省上饶市中考化学模拟冲刺题参考答案与试题解析
一.选择题
1.某同学用托盘天平称量固体物质时,把固体物质放在右盘,砝码放在左盘,称得固体物质的质量为10.8 g(1克以下用游码),如果按正确的方法称量,这位同学所称固体的实际质量是()
A.9.2 g B.9.8 g C.10.8 g D.10.2 g
【考点】称量器-托盘天平.
【专题】结合课本知识的信息.
【分析】根据天平的使用方法是左物右码,可知左盘的质量等于右盘的质量加游码的质量,即物体质量=砝码质量+游码质量,如果放错了,还要根据左盘的质量=右盘的质量+游码的质量,只不过砝码与物体位置交换了,列等式进行计算.
【解答】解:由左盘的质量=右盘的质量+游码的质量可知:砝码质量=物体质量+游码的质量,所以物码反放时物体质量=砝码质量﹣游码质量,即:物体质量=10.0 g﹣0.8 g=9.2 g.
故选A.
【点评】在计算有关天平的题目时,要谨记左盘的质量═右盘的质量+游码的质量,由此列等式计算,不管是左物右码还是左码右物,都可以算.
2.A、B、C三种物质各15g,它们化合时只能生成30g新物质D.若增加10gA,则反应停止后,原反应物种只余C.根据上述条件推断下列说法正确的是()
A.第一次反应停止后,B剩余9g
B.第二次反应后,D的质量为40g
C.反应中A和B的质量比是3﹕2
D.反应中A和C的质量比是5﹕2
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】若增加10gA,则反应停止后原反应物中只余C,说明此时反应掉的A为25g,B为15g,而在加入10gA前,A15g完全反应生成了30g的D.可以推知当25gA完全反应时生成的D为50g(为反应物A的质量的2倍),所以可以推知当25gA和15B反应时消耗的C的质量为50g﹣25g﹣15g=10g.
【解答】解:由题意,若增加10gA,则反应停止后原反应物中只余C,说明参加第二次反应的A的质量为25克,B的质量为15克,A与B参加反应的质量比为5:3;
A、B、C三种物质各15g,它们化合时只能生成30g新物质D,说明参加第一次反应的A的质量为15克,B的质量为9克,根据质量守恒定律可知参加第一次反应的C的质量为6克,又生成D的质量是30g,则反应中A、B、C、D的质量比为5:3:2:10,则第二次参加反应的C的质量为10克.
A、参加第一次反应的B的质量为9克,剩余6克.故不正确;
B、第二次参加反应的A的质量为25克,故第二次反应后D的质量是50g.故不正确;
C、反应中A与B的质量比为5:3.故不正确.
D、反应中A与C的质量比为5:2.故正确;
故选D.
【点评】质量守恒定律的应用是中考考查的重点,本题考查的是灵活运用质量守恒定律的思想处理问题的能力.
3.已知一个SO2分子的质量为n克,一个SO3分子的质量为m克,若以氧原子质量的![]() 作为相对原子质量的标准,则SO3的相对分子质量()
作为相对原子质量的标准,则SO3的相对分子质量()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【考点】相对分子质量的概念及其计算.
【专题】化学式的计算.
【分析】1个氧原子的质量为:(m﹣n)g;1个硫原子的质量为:n﹣2(m﹣n)g;根据相对原子质量的求法,进行分析求出SO3的相对分子质量.
【解答】解:1个氧原子的质量为:(m﹣n)g;
氧原子的相对原子质量为: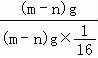 =16;
=16;
1个硫原子的质量为:n﹣2(m﹣n)g;
硫原子的相对原子质量为: =
=![]()
根据相对分子的质量为组成分子的各原子的相对原子质量之和,所以SO3的相对分子质量为![]() +16×3=
+16×3=![]() .
.
故选A.
【点评】本题考查学生对相对原子质量计算方法的理解与掌握,并能在解题中灵活应用的能力.
4.某反应2A+2B→2C,其中A和C有如图所示的质量关系.当有20gC生成时,消耗B的质量为(B的相对分子质量为30)()
A.10g B.5g C.15g D.13g
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【分析】据图象可知:参加反应的A和生成C的质量比,并结合质量守恒定律分析解答,在计算质量时与化学式前面的系数无关.
【解答】解:由图可知:当参加反应的A约是15g时,生成的C的质量是20g,所以消耗B的质量为:20g﹣15g=5g;
故选B.
【点评】本题考查了学生对于质量守恒定律的掌握及对图象的分析,考查了学生分析解决问题的能力.
5.氯酸钾和二氧化锰的混合物共A克,加热完全反应后得到B克氧气和C克氯化钾,则混合物中二氧化锰的质量为()
A.(A+B﹣C)克 B.(A﹣B﹣C)克 C.(A+B+C)克 D.(A+C)克
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应前后二氧化锰的质量不变;由题意,氯酸钾和二氧化锰的混合物共A克,加热完全反应后得到B克氧气和C克氯化钾,由质量守恒定律计算出参加反应的氯酸钾的质量,进而可计算出混合物中二氧化锰的质量.
【解答】解:氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应前后二氧化锰的质量不变;由题意,氯酸钾和二氧化锰的混合物共A克,加热完全反应后得到B克氧气和C克氯化钾,则混合物中氯酸钾的质量为(B+C)g,故混合物中二氧化锰的质量为Ag﹣(B+C)g=(A﹣B﹣C)g.
故选:B.
【点评】本题难度不大,掌握质量守恒定律并能灵活运用是正确解答本题的关键.
6.氢气和氧气的混合物共20g在一密闭容器内点燃,充分反应后生成18g水.则原混合物中氢气质量为()
A.2g B.4g C.2g或4g D.无法确定
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【分析】根据充分反应后生成18g水,利用化学反应方程式可知,2g氢气和16g氧气恰好完全反应生成18g水,则20g混合气体有剩余的气体存在,则有两种可能:①剩余气体为氢气;②剩余气体为氧气来分析解答.
【解答】解:设参加反应反应的氢气和氧气的质量分别为x、y.
2H2+O2![]() 2H2O
2H2O
4 32 36
x y 18g
![]()
x=2g,y=16g
①若剩余气体为氢气,则氢气的质量为2g+(20g﹣18g)=4g,即混合气体中有4g氢气和16g氧气;
②若剩余气体为氧气,则氧气的质量为16g+(20g﹣18g)=18g,即混合气体中有2g氢气和18g氧气.
故为:4g或2g.
故选:C.
【点评】本题考查学生利用化学反应方程式的计算来分析混合物的成分,学生应能利用化学反应判断恰好完全反应的量,要注意过量计算过程的思维训练.
二.填空题
7.(14分)用化学用语填空
(1)相对分子质量最小的氧化物: H2O(2)保持硫酸铜化学性质的粒子: Cu2+、SO42﹣(3)高锰酸根离子: MnO4﹣(4)画出He﹣3的结构示意图:  (5)碳酸钙的化学式为 CaCO3(6)岩石呈红色是含氢氧化铁所致,氢氧化铁原子团的化合价 Fe(
(5)碳酸钙的化学式为 CaCO3(6)岩石呈红色是含氢氧化铁所致,氢氧化铁原子团的化合价 Fe(![]() )3 .
)3 .
(7)标出KClO3中氯元素的化合价 K![]() O3 .
O3 .
【考点】化学符号及其周围数字的意义;原子结构示意图与离子结构示意图.
【专题】化学用语和质量守恒定律.
【分析】本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
【解答】解:(1)相对分子质量最小的氧化物是水,故填:H2O;
(2)保持硫酸铜化学性质的粒子是铜离子和硫酸根离子,故填:Cu2+、SO42﹣;
(3)高锰酸根离子带有1个单位的负电荷,故填:MnO4﹣,故填:MnO4﹣;
(4)He﹣3的结构示意图就是氦原子结构示意图,故填: ;
;
(5)碳酸钙的化学式为CaCO3;故填:CaCO3;
(6)氢氧化铁中原子团是氢氧根,其化合价为﹣1,故填:Fe(![]() )3.
)3.
(7)KClO3中氯元素的化合价为+5,故填:K![]() O3.
O3.
【点评】本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.
8.配平下列化学方程式
(1) 4 CuFeS2+ 13 O2═ 4 CuO+ 2 Fe2O3+ 8 SO2
(2) 1 C5H12+ 8 O2═ 5 CO2+ 6 H2O.
【考点】化学方程式的配平.
【专题】元素质量守恒;化学用语和质量守恒定律.
【分析】根据质量守恒定律:反应前后各原子的数目不变,选择相应的配平方法(最小公倍数法、定一法等)进行配平即可;配平时要注意化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数.
【解答】解:(1)本题可利用“定一法”进行配平,把CuFeS2的化学计量数定为1,则O2、CuO、Fe2O3、SO2前面的化学计量数分别为:![]() 、1、
、1、![]() 、2,同时扩大4倍,则CuFeS2、O2、CuO、Fe2O3、SO2前面的化学计量数分别为13、4、2、8.
、2,同时扩大4倍,则CuFeS2、O2、CuO、Fe2O3、SO2前面的化学计量数分别为13、4、2、8.
(2)本题可利用“定一法”进行配平,把C5H12的化学计量数定为1,则O2、CO2、H2O前面的化学计量数分别为:8、5、6.
故答案为:(1)4、13、4、2、8;(2)1、8、5、6.
【点评】本题难度不大,配平时化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数,配平过程中若出现分数,必须把分数去分母转化为整数.
9.有机物的命名与它的构成规律紧密相关.如有机物甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8),按此规律,丁烷的化学式为 C4H10 .
【考点】化学式的书写及意义;学习化学的重要途径及学习方法.
【专题】结合课本知识的信息.
【分析】找出有机物的规律,名称和碳原子的个数相对应,氢原子数目依次增加2.
【解答】解:由题意分析知道甲烷的碳原子数目为1,乙烷的碳原子数目为2,丙烷的为3,那丁烷的应该为4;
氢原子数目乙烷比甲烷多2,丙烷比乙烷多2,那丁烷应该比丙烷多2,应为10;
所以答案为C4H10
【点评】根据所给的信息,自己会总结规律,解决问题.这需要学生在平常的学习中,善于总结,善于运用.
10.工业盐酸常含有少量的三氯化铁,若其中H+与Cl﹣的个数比为94:97,则Fe3+与Cl﹣的个数比为 1:97 .
【考点】分子、原子、离子、元素与物质之间的关系.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据已有的知识进行分析,溶液不显电性,在溶液中阴离子和阳离子所带电荷数值相等.
【解答】解:H+与Cl﹣的个数比为94:97,则负电荷总数为97,氢离子所带正电荷总数为94,要保证阴离子所带负电荷数值与阳离子所带正电荷数值相等,则铁离子需要提供3个正电荷,一个铁离子带三个正电荷,故铁离子个数为1,所以Fe3+与Cl﹣的个数比为1:97.
答案:
【点评】本题考查了溶液中离子个数比的计算,完成此题,可以依据阴离子所带负电荷总数与阳离子所带正电荷数值相等进行.
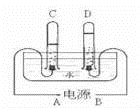
11.阿伏加德罗曾经总结出一条定律:在同温同压下,同体积的任何气体都含有相同的分子数.如图是实验室电解水的简易装置示意图.
①接通直流电源后,B电极为电源的 正 极,C管中的气体是 氢 气
②C、D两试管内气体的体积比为 2:1 .
③电解水反应的化学方程式: 2H2O![]() 2H2↑+O2↑ .
2H2↑+O2↑ .
④水电解过程中,发生变化的微粒是 水分子 ,不发生变化的微粒是 氢原子 和 氧原子 .(均填名称)
【考点】电解水实验;书写化学方程式.
【专题】空气与水.
【分析】由电解水生成气体是“负氢正氧”,且氧气与氢气的体积比是1:2,结合图示所示的气体体积进行分析有关的问题.再根据分子、原子在化学变化中变化,分析在水电解过程中微粒的变化.
【解答】解:①由电解水的简易装置示意图可知,D试管中收集的气体较少是氧气,应是电源的正极产生的气体,所以,B电极为电源的正极.则C管中的气体是氢气.
②由电解水的简易装置示意图可知,C、D两试管内气体的分别是氢气和氧气,体积比为2:1.
③电解水生成了氢气和氧气,反应的化学方程式:2H2O![]() 2H2↑+O2↑.
2H2↑+O2↑.
④由于分子在化学变化中能再分,原子不能再分,所以,水电解过程中,发生变化的微粒是水分子,不发生变化的微粒是氢原子和氧原子.
故答为:①正,氢;②2:1;③2H2O![]() 2H2↑+O2↑;④水分子;氢原子;氧原子.
2H2↑+O2↑;④水分子;氢原子;氧原子.
【点评】要熟记正氧负氢,氢二氧一,电解水实验得到的结论有:水是由氢元素和氧元素组成等,以上这些常是解决此类题的关键.
12.将14.0g硫在一定量的氧气中燃烧,记录如下数据:
实验次数 | 1 | 2 | 3 |
氧气的质量/g | 4.5 | 14.0 | 18.0 |
二氧化硫的质量/g | 9.0 | 28.0 | 28.0 |
分析数据,回答下列问题.
(1)在这三次实验中,第 2 次刚好完全反应.
(2)在第 1 次实验中硫有剩余,剩余 9.5 g.在第 3 次实验中氧气有剩余,剩余 4.0 g.若将剩余的硫在剩余的氧气中燃烧,可生成二氧化硫 8.0 g.
【考点】根据化学反应方程式的计算.
【专题】综合计算(图像型、表格型、情景型计算题).
【分析】根据硫燃烧的化学方程式可以计算硫和氧气恰好完全反应时的质量比,进一步可以判断每次反应的情况.
【解答】解:硫燃烧的化学方程式为:S+O2![]() SO2,
SO2,
反应物和生成物的质量关系为:32 32 64
硫、氧气、二氧化硫的质量比为1:1:2;
(1)第2次实验中,14.0g氧气和硫完全反应时消耗硫的质量为14.0g,恰好完全反应.
故填:2.
(2)第1次实验中,氧气的质量是4.5g,需要硫的质量为4.5g,剩余硫的质量为:14.0g﹣4.5g=9.5g;
第3次实验中,二氧化硫的质量没有增加,说明没有反应,氧气剩余,剩余质量为4.0g;
剩余的硫是9.5g,剩余的氧气是4.0,充分反应后氧气剩余,则4.0g硫完全燃烧生成二氧化硫的质量为8.0g.
故填:1;9.5;3;4.0;8.0.
【点评】本题主要考查学生运用假设法和化学方程式进行计算和推断的能力.
13.如图所示,在试管中的滤纸条上A、B、C三处各滴上一滴无色酚酞,再向试管口的棉花团上滴一些浓氨水.
(1)实验中,可以观察到A、B、C三处的酚酞溶液由 CBA (填A、B、C或(C、B、A)顺序先后变成 红 色.该实验说明分子的性质是 在不断的运动 .
(2)实验中,往往在试管下放一张白纸,白纸的作用是 起衬托作用,便于观察滤纸条的颜色变化 .

【考点】分子的定义与分子的特性.
【专题】实验性简答题.
【分析】(1)根据实验现象进行分析,氨水呈碱性,能使酚酞试液变红,据此解答即可;
(2)实验中,往往在试管下放一张白纸,白纸的作用是起衬托作用,使现象更明显.
【解答】解:(1)在试管中的滤纸条上A、B、C三处各滴上一滴无色酚酞溶液,试管口塞上一团蘸有浓氨水的棉花,由于分子在不断的运动,故可以观察到A、B、C三处的酚酞溶液变成红色,先后顺序为CBA.该现象说明分子在不断的运动.故填:CBA;红;在不断的运动;
(2)在试管下放一张白纸的作用是便于观察颜色的变化;故填:起衬托作用,便于观察滤纸条的颜色变化.
【点评】本题考查了如何探究物质的性质和变化规律,掌握反应现象与本质的联系,理解微粒观点的应用.
三.探究题
14.某兴趣小组同学对实验室制取氧气的条件进行如下探究实验.
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比试验:
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将xg KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.
Ⅰ中反应的化学方程式是 2KClO3![]() 2KCl+3O2↑ ;Ⅱ中x的值为 3.0 .
2KCl+3O2↑ ;Ⅱ中x的值为 3.0 .
②乙探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2的装置是 C (填序号).

实验结论:在相同条件下, 双氧水浓度越大 ,双氧水分解得快.
丙用如图装置进行实验,通过比较 相同时间天平读数差值大小 也能达到实验目的.
【考点】实验探究物质变化的条件和影响物质变化的因素;常用气体的发生装置和收集装置与选取方法;催化剂的特点与催化作用.
【专题】化学实验与探究;压轴实验题;科学探究.
【分析】根据已有的知识进行分析,①氯酸钾在二氧化锰的催化作用下加热能快速的产生氧气,进行实验探究时要注意控制变量,
②测量氧气的体积可以使用排水法,将排出的水的用量筒收集起来,排出的水的体积就是氧气的体积;根据表格数据即可得出影响反应速率的因素;丙使用的是称量剩余物质的质量的方法得出影响反应速率的因素.
【解答】解:①氯酸钾在二氧化锰的催化作用下加热能快速的产生氧气,进行实验探究时要注意控制变量,故X为3.0,故填:2KClO3![]() 2KCl+3O2↑,3.0;
2KCl+3O2↑,3.0;
②要将瓶内的水排出来,A和B都不可以,C可以,故填:C;
根据表格提供的数据可以看出,双氧水的浓度越大,相同的时间产生氧气的体积越大,故填:双氧水浓度越大;
丙使用的是称量剩余物质的质量的方法得出影响反应速率的因素,根据相同时间内天平读书的差值大小,可以看出反应的快慢,故填:相同时间天平读数差值大小.
【点评】本题考查了影响化学反应速率的因素,完成此题,可以依据题干提供的信息结合已有的知识进行.

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...