此试题可能存在乱码情况,在查看时请点击右上角全屏查看
2017年毕节中考化学试题
可能用到的相对原子质量:H:1 C:12 O:16 S:32 Fe:56 Cu:64
第Ⅰ卷(选择题)
一、选择题(本题包括16 小题,每小题3分,共48分。每题只有一个选项符合题意,请把该项的序号按要求在答题卡上相应的位置填涂)
1.认识物质及其变化,对于了解自然现象和规律至关重要。下列变化中,属于化学变化的是
A.酒精挥发 B.矿石粉碎 C.玉米酿酒 D.干冰升华
2.原子、分子、离子、元素等概念的学习有助于我们认识物质构成的奥秘。下列叙述错误的是
A.原子是化学变化中的最小粒子,一切变化中,原子都不能再分
B.由分子构成的物质,分子是保持其化学性质的最小粒子
C.带电的原子或原子团叫做离子,离子也是构成物质的微粒
D.元素是质子数(即核电荷数)相同的一类原子的总称
3.正确的实验操作是安全地进行实验并获得可靠实验结果的前提。下列各图所示的实验操作,正确的是
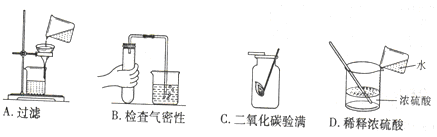
4.正确使用化学用语是重要的化学学科素养。下列说法正确的是
A.H2O、H2O2、H2SO4中均含有氢分子
B.KCl、KClO、KClO3中氯元素的化合价相同
C.![]() 、
、![]() 、
、![]() 表示的粒子都是阳离子
表示的粒子都是阳离子
D.CO、CO2、H2CO3都是含碳元素的化合物
5.分类法在科学研究中具有广泛的应用。下列各组物质的分类,错误的是
A.NH4Cl、NH4HCO3、CO(NH2)2(尿素)都属于铵盐
B.金刚石、石墨、C60都属于单质
C.棉花、羊毛、天然橡胶都属于天然有机高分子材料
D.糖类、油脂、蛋白质都属于基本营养素
6.化学与我们的日常生活紧密相关。下列说法错误的是
A.生活中常用肥皂水检验硬水和软水,硬水通过煮沸可以降低硬度
B.生活中常见的物质(括号内为主要成分):生石灰(CaO)、食醋(CH3COOH)、熟石灰(Ca(OH)2)、石灰石(CaCO3),它们的主要成分分别属于氧化物、酸、碱、盐
C.生活中火灾时有发生,炒菜时油锅着火可用锅盖盖灭,家用电器着火立即用水灭火
D.生活中常食用的一些果汁的pH分别为:苹果汁(2.9-3.3)、橘子汁(3-4)、葡葡汁(3.5-4.5),胃酸过多的人应少喝上述果汁
7.生活和生产中的一些实际问题可用化学知识分析、解释。下列说法错误的是
A.金属生锈是世界面临的难题,铁生锈是铁与水、氧气共同作用的结果
B.综合运用沉淀、过滤、蒸馏几项操作净水效果更好
C.衣服、餐具上的油污可以用加入洗涤剂的水洗掉,是利用了洗涤剂的乳化原理
D.人体缺少必需微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
8.具有“天下第一洞”美誉的织金洞是国家级风景名胜区,溶洞中形态各异的石笋和钟乳石的形成过程发生了一系列变化,其中化学反应有Ca(HCO3)2=X↓+CO2↑+H2O(方程式已配平),则X的化学式是
A.CaO B.CaCO3 C.Ca(OH)2 D.CaO2

17.金属和金属材料在日常生活中有广泛用途。请回答下列问题:
(1)地壳中含量最高的金属元素是__________(填元素符号)。
(2)现有甲、乙、丙三种金属,如果把甲和乙分别放人稀硫酸中,甲溶解并产生氢气,乙不反应;如果把乙和丙分别放人硝酸银溶液中,过一会儿,在乙表面有银析出,而丙没有变化。根据以上实验事实,判断甲、乙、丙的金属活动性由强到弱的顺序是_____________。
(3)铜丝浸入硝酸银溶液中,可发生反应:Cu+2AgNO3=Cu(NO3)2+2Ag,该反应属于四种基本反应类型中的__________反应。
18.“宏观现象一微观结构一符号表征”是学习化学的思维方法。下图表示在催化剂作用下将汽车尾气中的一氧化碳、二氧化氮转化为无害气体的反应原理。

(1)用化学符号表示5 个二氧化氮分子_____________。
(2)上图所示反应物和生成物中属于单质的是________(填化学式)。
(3)上图所示的化学反应方程式为_______________。
19.根据下表中NaCl和KNO3部分溶解度数据分析,回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)30℃时,NaCl的溶解度是_________g。
(2)NaCl与KNO3相比较,溶解度受温度变化影响较小的物质是___________。
(3)20℃ 时,在100g水中加人50gNaCl或50g KNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液,则加入的物质是______________。
20.化学是造福人类的自然科学。化学与能源、环境、材料等密切相关,请回答下列问题:
(1)能源化学一一使用新能源的汽车可节约化石燃料。化石燃料包括煤、石油和________(填名称)。
(2)环境化学——为了保护水质,下列做法合理的是___________(填序号)。
①随意丢弃废旧电池 ②生活污水经处理达标后排放
③农业上大量施用农药、化肥 ④工业“三废”未经处理任意排放
(3)材料化学——“2017年贵阳国际大数据产业博览会”展出的“智能机器人”的制作材料有:锂电池、铜导线、合成橡胶、合金材料等,其中属于有机合成材料的是___________。
三、化学实验题(本题包括2小题,每空1分,共16分。请将下列题中①-⑧序号所占位置应答答案填写在答题卡上相应的位置)
21.实验室部分装置如A-E图所示。
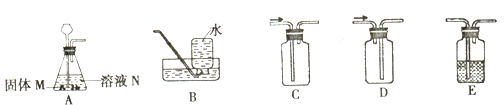
请回答下列问题:
(1)用所给装置制取并收集不同气体,填写下表空白。
固体M | 溶液N | 制取的气体 | 收集装置 |
大理石 | _____① _______ | CO2 | _____② ______ |
____③ ______ | 过氧化氢溶液 | O2 | ____④ ____或C |
锌粒 | 稀硫酸 | ____⑤ ____ | B或____⑥ ____ |
(2)收集干燥的CO2还需要用装置E,E中盛装的试剂为_______⑦ ______。
(3)用上图装置A制取O2时发生反应的化学方程式为________⑧ ________。
22.某同学查阅资料得知,实验室常用电石(主要成分CaC2)与水反应制取乙炔(C2H2),反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑(电石中的杂质不溶于水且不与水反应,也不与Na2CO3反应)。在实验室中,该同学把一定量的CaC2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
[提出问题]:滤液中溶质的成分是什么?
[猜想与假设]:猜想一:NaOH、Na2CO3
猜想二:NaOH
猜想三:NaOH、Ca(OH)2
[分析与推理]:
分析一:若猜想一成立,说明实验中加人的CaC2量少,CaC2与水反应生成的Ca(OH)2与Na2CO3反应后,Na2CO3剩余。
分析二:若猜想二成立,说明实验中加人的CaC2与水反应生成的Ca(OH)2与Na2CO3恰好完全反应。
分析三:若猜想三成立,说明实验中加人的CaC2量多,CaC2与水反应生成的Ca(OH)2与Na2CO3反应后,Ca(OH)2剩余。
由以上分析可推知:反应后滤液中一定存在的溶质是____① ___(①②③填化学式),可能存在的溶质是___② __和___③ ___。对可能存在的溶质,需进一步实验验证。
[设计并实验]:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,向其中加人过量稀盐酸 | 无气泡产生 | 猜想___④ ___不成立 |
实验二 | 另取少量滤液于试管中,向其中滴入适量碳酸钠溶液 | ___⑤ ___ | 猜想三成立,发生反应的化学方程式为 ______⑥ ___ |
[拓展延伸]:
若向CuCl2溶液中加人少量CaC2,充分反应,可观察到有气泡产生,同时出现蓝色的___⑦ ___ (填化学式)沉淀。
实验室保存电石应注意___⑧ ___。
四、化学计算题(本题包括2小题,其中23题2分,24题6分,共8分。23题直接填写计算结果,24题要求写出解题过程,请将答案填写在答题卡上相应的位置)
23.食物淀粉在人体内经过酶的催化作用,与水发生一系列反应,最终变成葡萄糖,葡萄糖经过肠壁吸收进入血液成为血糖,为人体组织提供营养。葡萄糖的化学式为C6H12O6,请根据该化学式进行计算:
(1)葡萄糖中碳、氢、氧元素的质量比为___________。(结果填最简整数比)
(2)葡萄糖中碳元素的质量分数是__________。
24.早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱。现将2.8g 铁粉投入40g硫酸铜溶液中,充分搅拌后,两者恰好完全反应。请计算:
(1)反应后生成铜的质量是多少?
(2)反应前硫酸铜溶液中溶质的质量分数是多少?
(3)反应后溶液中溶质的质量分数是多少?(结果精确至0.1%)
![]()

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...