各位同学在查看时请点击全屏查看
2018年安顺中考化学冲刺试题
一、选择(每小题2分,共30分)
1.世界是物质的,物质是变化的。下列属于物理变化的是 ( )
A.冰雪融化 B.钢铁生锈 C.牛奶变酸 D.食物腐败
2.由于森林过量砍伐,草场大面积开垦,土地出现沙漠化,导致最近我国北方多次出现沙尘暴天气,沙尘暴使空气中增加了大量的
A、二氧化硫 B、一氧化碳 C、二氧化氮 D、粉尘
3.固体物质受热变成气体,这种变化( )
A.一定是物理变化 B.一定是化学变化
C.可能是物理变化,也可能是化学变化 D.不是物理变化,也不是化学变化
4.据报道,“神舟六号”载人飞船将于今年下半年发射,届时将搭载2名航天员,在太空飞行5天。下一步,中国航天的目标将瞄准建立空间站和空间实验室。若在太空飞船中点燃一根火柴,火柴会
A.能够燃烧,和地球上现象相同 B.不能持续燃烧,很快就熄灭
C.能够燃烧,且燃烧更剧烈 D.以上答案都不对
5. 下列说法正确的是 ( )
A.厨房洗涤剂具有溶解油污的作用 B.冰投入水中,冰是溶质,水是溶剂
C.NaCl溶于水制成的冰袋可用于给高烧病人降温 D.冬季向公路上的积雪撒盐,可使冰雪快速融化
6.现有我们比较熟悉的四种物质,其中属于氧化物的是
A.液态氧 B.铝合金 C.沼气 D.生石灰
7.实验室里用石灰石与盐酸反应制取二氧化碳时,下列哪种仪器肯定不用 ( )
A.集气瓶 B.酒精灯 C.试管 D.导气管
8.你注意过吗,靠近自来水管的瓷砖上常有一些棕黄色斑迹,其主要成分和除去方法均正确的是
A.FeO、稀盐酸 B.Fe2O3、稀盐酸 C.Fe(OH)3、稀硫酸 D.FeCO3、稀硫酸
9.现有X、Y、Z三种金属,根据下列化学方程式可知,三种金属的活动性顺序是
①Z+YSO4 == ZSO4 +Y ②X+YSO4 == XSO4 +Y ③Z+H2SO4 == ZSO4 +H2↑④X+H2SO4不发生反应
A.Z > X > Y B.Z > Y > X C.X > Y > Z D.X > Z > Y
10.四位同学上网学习,用连线方法对所学知识进行整理,其中完全正确的是 ( )
A.小静同学对“物质与粒子的关系”连线如下:
![]() 金属银 离子构成
金属银 离子构成
氧气 原子构成
氯化钠 分子构成
B.小于同学对“人体必需营养素通过食品摄入”连线如下:
![]() 蛋白质 菜油、猪油
蛋白质 菜油、猪油
糖类 牛肉、鸡蛋
油脂 大米、面粉
C.小军同学对“世纪工程与工程作用”连线如下:
![]() 西气东输 能源的合理利用
西气东输 能源的合理利用
南水北调 水资源合理利用
退耕还林 有利人与自然和谐发展
D.小芳对“污染源一污染物质—解决策略”连线如下:
新装修房屋——黄曲霉素——通风或使用无毒、无污染原料
长期吸烟——尼古丁、CO——戒烟
霉变食物——甲醛、苯等——不食用
11.李大爷发现自家的菜地里种植的青菜叶色发黄,生长缓慢。请你帮他诊断一下,建议施用下列化肥中的
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
12.过生日时,父母都会为我们买来精美的蛋糕,插上漂亮的生日蜡烛。点燃后,让我们吹灭……我们学化学的第一个实验也是观察和描述蜡烛的燃烧。图示是实验中可以完成的几个步骤,请分析下列结论中不正确的是
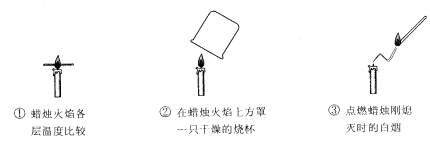
A.实验要先观察物质的物理性质,这是与平时点燃蜡烛的明显不同之处
B.由①可以清楚地观察到外焰温度最高
C.由②可说明蜡烛燃烧生成了二氧化碳 D.由③可证明蜡烛固体可以燃烧
13.为除去下列物质中混有的杂质(括号中为杂质),所选试剂正确的是
A.NaOH(Na2CO3):CaCl2溶液 B.ZnCl2(盐酸、CuCl2):Fe片
C.NaNO3(MgSO4):Ba(OH)2溶液 D.CO2(HCl):NaOH溶液
14、右图是盐酸滴入氢氧化钠溶掖中,有关粒子之间反应的示意图。下列说法错误的是
A.盐酸溶液中含有氢离子和氯离子B.氢氧化钠溶液中含有钠离子和氢氧根离子
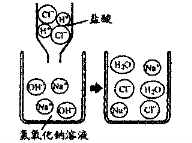 C.两种溶液混合时,氢离子与氢氧根离子结合生成了水分子
C.两种溶液混合时,氢离子与氢氧根离子结合生成了水分子
D.两种溶液混合时,钠离子与氯离子结合生成了氯化钠分子
15.在一个密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应。测得反应前后各物质的质量如下:
物 质 | X | Y | Z | Q |
反应前质量/g | 0 | 160 | 20 | 50 |
反应后质量/g | 222 | 0 | 2 | 6 |
则该密闭容器中发生的化学反应类型为 ( )
A.置换反应 B.分解反应. C.化合反应 D.复分解反应
题号 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题(每空2分 共30分)
16.在日常生活和生产中,酒精、醋酸、纯碱、盐酸、熟石灰、大理石、高锰酸钾、石墨、草木灰等物质,都有着重要的用途。选择上述物质填空(填主要成分的化学式)
(1)食醋中含有 ;(2)做干电池中电极的是 ;(3)可用作建筑、艺术雕刻和装饰品材料的是 ;(4)常用来改良酸性土壤、配制农药波尔多液的是 。
17.化学与人体健康密切相关,若人体血液缺铁,就会“贫血”;人体缺钙,会患佝偻病;缺碘会引起甲状腺肿大;缺氟易产生龋齿;缺锌会引起食欲不振等。
(1)市场有“朴雪(补血)口服液”、“高钙牛奶”、“加碘食盐”、“加氟牙膏”、“葡萄糖酸锌”等商品,这些铁、钙、碘、氟、锌应理解为(填编号)
①元素 ②原子 ③分子 ④氧化物
(2)市售麦片中含有微量极细的还原铁粉,饮用这种麦片后,铁在胃液中变为亚铁盐的化学方程式为
(3)市售AD营养布丁的配料为:①蔗糖②奶粉③乳酸钙④柠檬酸⑤维生素A⑥维生素D⑦食用色素 ⑧食用香料⑨防腐剂其中属于营养素的有(填编号)
18.(1)现有H+、OH-、NO3-、Fe3+四种离子,请写出它们可能组成的酸、碱、盐的化学式:酸 ;碱 ;盐 。
(2)根据表中示例填空:
类别 | 物质 | 化学性质(方程式) | 用途 |
酸 | 稀硫酸 | Fe203+3H2==Fe2(SO4)3+3H2O | 金属制品的除锈 |
碱 | 氢氧化钙溶液 |
|
|
| 氢氧化铝固体 |
| 治疗胃酸过多 |
盐 | 碳酸钙固体 |
|
|
 三、实验(每空3分 共30分)K 39 Mn 55
三、实验(每空3分 共30分)K 39 Mn 55
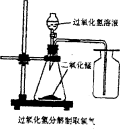
19.实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)或加热高锰酸钾的方法制取氧气。
(1)写出用上述两种方法分别制取氧气的化学反应方程式:
、 。
(2)用过氧化氢分解制取氧气的装置如右图所示:
图中收集氧气的方法叫做 。可用此方法收集氧气的原因是 。
(3)用该方法收集氧气时.,检验集气瓶中氧气是否集满的方法是 。
A.把点燃的木条伸入瓶内 B.把带火星的木条伸人瓶内
C.把带火星的木条放在瓶口
(4)如果锥形瓶中的反应很剧烈,应该采取的安全措施是 (填编号)。
①减慢液体滴加的速度②换用体积较小的锥形瓶③加热锥形瓶
(5)请计算,制取3.2g氧气,理论上需高锰酸钾的质量为 g;需质量分数为30%过氧化氢溶液的质量为 g。
(6)某化学试剂公司报价:高锰酸钾30.50元/kg,30%过氧化氢溶液21.70元/kg。请从实验操作和生产成本两方面考虑,用 方法制取氧气更好(二氧化锰价格低、耗量少,忽略不计)。这种方法的主要优点是 。
四、计算(10分)Ca 40 C 12 O 16 Cl 35.5 H 1
20.为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80mL(密度为1.1g/cm3)的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸的体积与反应后剩余固体的质量见下表。(计算结果保留到小数点后一位数字)
次 数 | 一 | 二 | 三 | 四 |
加入盐酸的体积/mL | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 14 | 8 | 3 | 3 |
计算:(1)样品中碳酸钙的质量分数;
(2)20g此样品与足量盐酸反应最多生成二氧化碳的质量;
(3)加入的稀盐酸中溶质的质量分数。
2018年安顺中考化学冲刺试题参考答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
A | D | C | B | D | D | B | B | A | A | A | C | C | D | C |
16. CH3COOH; C; CaCO3; Ca(OH)2。17.(1)① (2)Fe+2HCl==FeCl2+H2↑(3)①②③⑤⑥
18.(1)HNO3 Fe(OH)3 Fe(NO3)3
(2)
类别 | 物质 | 化学性质(方程式) | 用途 |
酸 |
|
|
|
碱 |
| Ca(OH)2+CO2==CaCO3↓+H2O | 检验二氧化碳气体 |
|
| 2Al(OH)3+6HCl==2AlCl3+3H2O |
|
盐 |
| CaCO3+2HCl==CaCl2+H2O+CO2↑ | 实验室制二氧化碳 |
19. (1)2H2O2==2H2O+O2↑;2KMnO4 ==K2MnO4+MnO2+O2↑
(2)向上排空气法 O2的密度比空气密度略大 (3)C(4)①
(5)31.622.7 (6)分解过氧化氢。①实验室用H2O2制取02不需加热 ②制取相同质量(3.2g)O2时购买H2O2(约0.49元)比KMnO4(约0.96元)价格低。
20.解:(1)由表中数据可知,20g样品中含杂质3g,样品中CaCO3 的质量分数为:
(17g/20g)×100% = 85% (2分)
(2)设20g(即含17g CaCO3)的样品与足量盐酸反应最多生成CO2的质量为x,
CaCO3 + 2HCl== CaCl2 + CO2↑+ H20
100 44
17g x
X = 7.5g (2分)
(3)设20mL稀盐酸中含溶质的质量为y
CaCO3 + 2HCl== CaCl2 + CO2↑+ H20
100 2×36.5
6g y
y = 4.38g (2分)
HCl% = (4.38g/20mL×1.1g/cm3)×100% = 19.9% (1分)
答:略。

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...