各位同学在查看时请点击全屏查看
2018年遵义中考化学冲刺试题
一、选择题
1.今年我国部分省市实行实时公布空气![]() 的“清新指数”.“清新指数”是国际公认的一种空气清洁度标准.下列做法对“清新指数”会产生不利影响的是( )
的“清新指数”.“清新指数”是国际公认的一种空气清洁度标准.下列做法对“清新指数”会产生不利影响的是( )
A.使用节能灯泡,提倡节约用电
B.大力发展风能,减少火力发电
C.用布袋代替一次性塑料袋购物
D.增加私家车用量,提高生活质量
2.安徽物产丰富.以下安徽名产中不含有机物的是( )
A.
名茶﹣黄山银勾
B.
名食﹣涂山农家圆子
C.
名酒﹣淮北口子窖
D.
名砚﹣歙县龙尾砚
3.鱼肝油是一种药品,主要含维生素A(C20H30O)、维生素D(C28H44O)等,下列有关说法不正确的是( )
A.维生素A中C、H、O的原子个数比为20:30:1
B.鱼肝油是一种新型化合物
C.维生素D中氧元素的质量分数最小
D.维生素A、维生素D都是有机物
4.以下实验基本操作不正确的是( )
A.
检查气密性
B.
加热液体
C.
熄灭酒精灯
D.
取用粉末状药品
5.汽车安装三元催化装置,可以有效减少尾气污染,其反应原理之一是:2NO2CO![]() N22CO2.下列有关说法正确的是( )
N22CO2.下列有关说法正确的是( )
A.汽车尾气的氮氧化合物主要汽油的不充分燃烧
B.该反应是置换反应
C.氮元素的化合价在化反应前后发生了变化
D.催化剂的质量和化性质在化反应前后发生了变化
6.2014年我国纪念“世界水日”和“中国水周”活动的宣传主题为“加强河湖管理,建设水生态文明”. 下列用水行为符合这一主题的是( )
A.控制水中所有动植物的生长
B.废水只要无色透明就可以直接排放
C.合理使用农药、化肥
D.将生活垃圾随意丢入河中
7.美国加州大在加速器中用氦核轰击锿原子,制得了101号元素.为纪念伟大的化家门捷列夫,将它命名钔(如图),下列说法正确的是( )
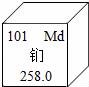
A.氦核轰击锿原子,制得钔原子过程中,质子数发生了改变
B.该元素属于非金属元素
C.该元素在地壳中的含量为258.0%
D.该元素的原子核外有157个电子
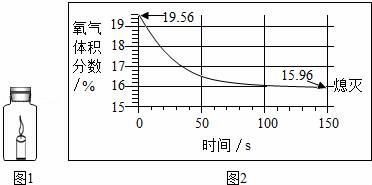
8.蜡烛(足量)在如图1所示的密闭容器内燃烧至熄灭,用仪器测出这一过程中瓶内氧气含量的变化(如图2所示).下列判断中,不正确的是( )
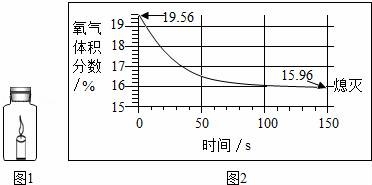
A.瓶中氧气浓度小于一定值时,蜡烛无法燃烧
B.实验过程中瓶中二氧化碳的含量增大
C.该过程中瓶内物质总质量不变
D.蜡烛熄灭原因是瓶内没有了氧气
9.总结化规律要严谨、.下列说法中正确的是( )
A.酸溶液中一定含有氢离子
B.气体受热膨胀是因为温度升高气体分子变大
C.生成盐和水的反应一定是中和反应
D.一定温度下的浓溶液一定是饱和溶液
10.研究表明,木糖醇是一种理想的蔗糖替代品,它具有甜味足、溶解性好、防龋齿,适合糖尿病患者食用的优点.根据木糖醇和蔗糖的溶解度曲线,下列叙述不正确的是( )
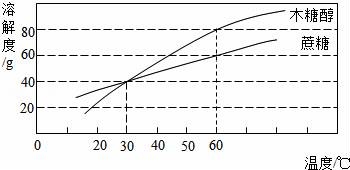
A.木糖醇和蔗糖都是易溶物
B.30℃时两种物质的溶液溶质质量分数相等
C.60℃时,40g木糖醇加入50g水,能得到90g溶液
D.在人体正常体温时,木糖醇溶解度大于蔗糖
二、非选择题
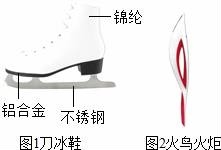
11.在2014年索契冬季奥运会上,中国运动员共获得了九枚奖牌,成为亚洲体坛霸主.
(1)图1是速度滑冰运动员使用的刀冰鞋.
①刀冰鞋中含有的金属单质是__________(写化式),属于有机合成材料的是__________.
②制造刀冰鞋的铝合金材料具有较好的抗腐蚀性,请用化方程式表示铝具有较好的抗腐蚀性的原因__________.
(2)图2是2014年索契冬奥会的火炬,火炬外形像神话传说中的火鸟.采集圣火,在太阳光下将火炬燃料喷口伸向凹面镜焦点位置,打开阀门,火炬将被点燃.火炬能被点燃的原因是__________.火炬传递结束后,采用关闭燃气阀门的方法熄灭火炬,其中蕴含的灭火原理是__________.
12.化用语是习和交流化知识的通用语言.下列三种物质:
①熟石灰 ②硝酸钾 ③氢氧化铝,请选择合适物质用化式填空:
(1)可用于治疗胃酸过多的是__________;(2)用于降低土壤酸性的__________;(3)属于复合肥的是__________.
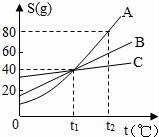
13.(1)如图是A、B、C三种物质的溶解度曲线图,看图后回答下列问题:
①三种物质中,溶解度受温度影响最大的是__________物质.
②在温度为__________℃时,A、B、C三种物质的溶解度相等.要从C物质的溶液中得到C晶体,最好采用的方法是__________.
(2)日常生活中除去油污的方法很多,下列现象不属于乳化的是__________.
A.洗面奶洗去皮肤上的油污 B.洗发精洗去头发上的油污
C.修车工用汽油洗去手上的油污 D.洗洁精洗去餐具上的油污.
14.在通常状况下,氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液俗称氨水.请根据如图回答:
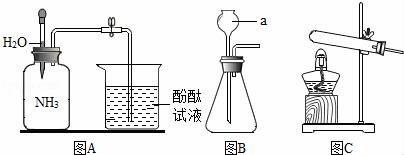
(1)指出上图中仪器a的名称:__________.
(2)某同设计了如图A所示的实验:挤压滴管胶头,使滴管中的水进入广口瓶,打开止水夹,你将观察到的现象是__________、__________由此可知氨气易溶于水,且氨水的pH__________(填“>”、“=”或“<”).
(3)实验室常用加热氯化氨与消石灰的固体混合物制取氨气,其发生装置可选用上图中__________的装置,收集氨气可采用__________法,干燥氨气可选用__________( 填“生石灰”或“浓硫酸”).
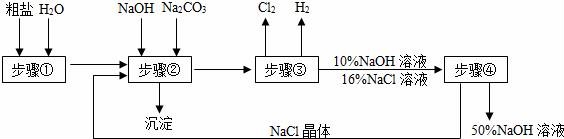
15.以粗盐(主要成分是NaCl,含有不溶性泥砂、可溶性的MgCl2、CaCl2等杂质)为原料,电解食盐水生产氢氧化钠的简要流程如图:

(1)步骤①除去不溶性杂质,其主要操作有溶解、__________.
(2)步骤②除去可溶性杂质,写出其中一个化方程式__________.
(3)写出步骤③中一种单质的名称__________,工业上可利用本步骤中产生的两种气体生产盐酸,写出盐酸的一种用途__________.
(4)步骤④中制得的氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要__________.
(5)该流程中可以循环利用的物质是__________.
16.为了测定某品牌小苏打样品中碳酸氢钠的质量分数,兴趣小组进行了如图所示的实验(假设该样品中只含有氯化钠一种杂质).请计算:
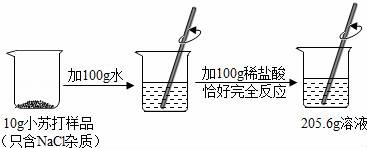
(1)生成CO2气体的质量;
(2)样品中碳酸氢钠的质量分数.
2018年遵义中考化学冲刺试题参考答案
一、选择题
1.今年我国部分省市实行实时公布空气的“清新指数”.“清新指数”是国际公认的一种空气清洁度标准.下列做法对“清新指数”会产生不利影响的是( )
A.使用节能灯泡,提倡节约用电
B.大力发展风能,减少火力发电
C.用布袋代替一次性塑料袋购物
D.增加私家车用量,提高生活质量
考点:防治空气污染的措施.
专题:空气与水.
分析:A、节约用电就可以减少煤的使用;
B、火力发电会增加空气的污染;
C、减少塑料袋的使用,会减少白色污染;
D、增加私家车的使用,会加大空气污染.
解答: 解:A、节约用电就可以减少煤的使用,从而减少空气污染,对“清新指数”会产生有利影响,故不符合题意;
B、火力发电会增加空气的污染,大力发展风能,减少火力发电,对“清新指数”会产生有利影响,故不符合题意;
C、减少塑料袋的使用,会减少白色污染,对“清新指![]() 数”会产生有利影响,故不符合题意;
数”会产生有利影响,故不符合题意;
D、增加私家车的使用,会加大空气污染,对“清新指数”会产生不利影响,故符合题意.
故选D.
点评:本考点考查了空气的污染及其危害,环保问题已经引起了全球的重视,化上提倡绿色化工艺,要从头上杜绝污染.
2.安徽物产丰富.以下安徽名产中不含有机物的是( )
A.
名茶﹣黄山银勾
B.
名食﹣涂山农家圆子
C.
名酒﹣淮北口子窖
D.
名砚﹣歙县龙尾砚
考点:有机物与无机物的区别.
专题:物质的分类.
分析:根据有机物的定义,含有碳元素的化合物为有机物进行解答.
解答: 解:A、茶叶中含有蛋白质、氨基酸、脂肪、维生素、微量元素等多种营养物质,蛋白质、氨基酸等等都属于有机物,故A中含有有机物;
B、食物中一般含有糖类、脂肪、蛋白质等营养物质,故B含有有机物;
C、酒的主要成分是乙醇,属于有机物,故C含有有机物;
D、砚的主要成分是碳酸钙,虽含有碳元素但性质同无机物相似,常归到无机物类,故D中不含有机物.
故选D.
点评:本题考查了有机物的定义以及常见物质的成分,注重基础.
3.鱼肝油是一种药品,主要含维生素A(C20H30O)、维生素D(C28H44O)等,下列有关说法不正确的是( )
A.维生素A中C、H、O的原子个数比为20:30:1
B.鱼肝油是一种新型化合物
C.维生素D中氧元素的质量分数最小
D.维生素A、维生素D都是有机物
考点:化式的书写及意义;单质和化合物的判别;有机物与无机物的区别.
专题:化用语和质量守恒定律.
分析:A.根据物质的化式分析原子个数比;
B.根据物质的组成判断物质的类别;
C.根据化合物中,元素质量分数的计算方法分析;
D.根据有机物的概念判断.
解答: 解:A.由维生素A的化式C20H30O可知,维生![]() 素A中C、H、O的原子个数比为20:30:1,正确;
素A中C、H、O的原子个数比为20:30:1,正确;
B.鱼肝油主要含维生素A(C20H30O)、维生素D(C28H44O)等,可见是一种混合物,错误;
C.维生素D中碳原子的相对原子质量之和为12×28,氢原子的相对原子质量之和为1×44,氧原子的相对原子质量之和为16,由于氧原子的相对原子质量之和最小,则维生素D中氧元素的质量分数最小,正确;
D.由维生素A和维生素D的化式可知,均为含碳元素的化合物,属于有机物,正确.
故选B.
点评:本题难度不大,考查同们结合新信息、灵活运用有机物、化式的含义与有关计算进行分析问题、解决问题的能力.
4.以下实验基本操作不正确的是( )
A.
检查气密性
B.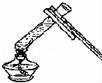
加热液体
C.
熄灭酒精灯
D.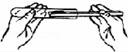
取用粉末状药品
考点:检查装置的气密性;加热器皿-酒精灯;固体药品的取用;给试管里的液体加热.
专题:常见仪器及化实验基本操作.
分析:A、根据检查装置气密性的方法进行分析判断.
B、根据给试管中的液体加热的方法进行分析判断.
C、使用酒精灯时要注意“两查、两禁、一不可”.
D、根据向试管中装粉末状固体药品的方法进行分析判断.
解答: 解:A、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确.
B、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的![]() ,图中液体超过试管容积的
,图中液体超过试管容积的![]() ,图中所示操作错误.
,图中所示操作错误.
C、使用酒精灯时要注意“两查、两禁、一不可”,熄灭酒精灯时,不能用嘴吹灭酒精灯,应用灯帽盖灭,图中所示操作正确.
D、取用粉末状药品,试管横放,用药匙或纸槽把药品送到试管底部,图中所示操作正确.
故选:B.
点评:本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化实验基本操作的注意事项是解答此类试题的关键.
5.汽车安装三元催化装置,可以有效减少尾气污染,其![]() 反应原理之一是:2NO2CO
反应原理之一是:2NO2CO![]() N22CO2.下列有关说法正确的是( )
N22CO2.下列有关说法正确的是( )
A.汽车尾气的氮氧化合物主要汽油的不充分燃烧
B.该反应是置换反应
C.氮元素的化合价在化反应前后发生了变化
D.催化剂的质量和化性质在化反应前后发生了变化
考点:防治空气污染的措施;催化剂的特点与催化作用;有关元素化合价的计算;反应类型的判定.
专题:空气与水.
分析:A、汽车尾气的氮氧化合物主要于气缸中N2被氧化生成的;
B、根据置换反应的定义分析;
C、根据氮元素的化合价的变化分析;
D、根据催化剂的特点分析.
解答: 解:A、汽车尾气的氮氧化合物主要于气缸中N2被氧化生成的,故错误;
B、置换反应时指由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应叫做置换反应,题目中的反应不属于化![]() 合反应,故错误;
合反应,故错误;
C、氮元素的化合价在化反应前是2价,反应后生成单质氮气,化合价是0,故正确;
D、催化剂是指在化反应中能改变其他物质的化反应速率,而本身的质量和化性质在反应前后不变的物质,故错误.
故选C.
点评:本题考查汽车尾气的污染、置换反应、元素的化合价、催化剂的特点,难度不大,细心解答.
6.2014年我国纪念“世界水日”和“中国水周”活动的宣传主题为“加强河湖管理,建设水生态文明”. 下列用水行为符合这一主题的是( )
A.控制水中所有动植物的生长
B.废水只要无色透明就可以直接排放
C.合理使用农药、化肥
D.将生活垃圾随意丢入河中
考点:水资的污染与防治.
专题:空气与水.
分析:A、水中动植物的生长不会污染水体;
B、无色透明的废水中也会含有污染物质;
C、合理使用农药、化肥不会造成水污染;
D、生活垃圾随意丢入河中,会造成水体污染.[]
解答: 解:A、水中动植物的生长不会污染水体,所以不需要控制水中所有动植物的生长,故错误;
B、无色透明的废水中也会含有污染物质,所以不能直接排放,故错误;
C、合理使用农药、化肥不会造成水污染,符合“加强河湖管理,建设水生态文明”.故正确;
D、生活垃圾随意丢入河中,会造成水体污染,不符合“加强河湖管理,建设水生态文明”,故错误.
故选C.
点评:水资的污染、保护和利用是人们关注的热点,也是考查的热点,了解节约保护水资的措施即可正确解答本题.
7.美国加州大在加速器中用氦核轰击锿原子,制得了101号元素.为纪念伟大的化家门捷列夫,将它命名钔(如图),下列说法正确的是( )
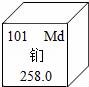
A.氦核轰击锿原子,制得钔原子过程中,质子数发生了改变
B.该元素属于非金属元素
C.该元素在地壳中的含量为258.0%
D.该元素的原子核外有157个电子
考点:元素周期表的特点及其应用.
专题:化用语和质量守恒定律.
分析:A.根据质子数决定元素的种类解答;
B.根据元素的名称解答;
C.根据元素周期表信息解答;
D.根据质子数等于核外电子数解答;
解答: 解:A.由于氦核轰击锿原子,制得钔原子,生成了新的元素,元素不同质子数不同;故正确;
B.有元素名称可知该元素是金属元素,故错误;
C.元素周期表信息可知该元素的相对原子质量为258.0;故错误
D.元素周期表信息可知该元素的原子核外有101个电子,错误.
答案:A
点评:本题考查元素周期表的结构及应用,把握周期与族的化分、原子结构与元素位置的关系为解答的关键,注重基础知识的考查,题目难度不大,
8.蜡烛(足量)在如图1所示的密闭容器内燃烧至熄灭,用仪器测出这一过程中瓶内氧气含量的变化(如图2所示).下列判断中,不正确的是( ![]() )
)
A.瓶中氧气浓度小于一定值时,蜡烛无法燃烧
B.实验过程中瓶中二氧化碳的含量增大
C.该过程中瓶内物质总质量不变
D.蜡烛熄灭原因是瓶内没有了氧气
考点:蜡烛燃烧实验.
专题:结合课本知识的信息.
分析:根据已有的知识结合图示进行分析,反应前氧气的体积分数是19.56%,当氧气的体积分数达到15.96%时,蜡烛熄灭,说明开始时瓶内含有其他气体,氧气的浓度低于一定值时,蜡烛无法燃烧,蜡烛燃烧生成二氧化碳和水,任何化反应都遵循质量守恒定律.
解答: 解:A.当氧气的体积分数达到15.96%时,蜡烛熄灭,说明氧气的浓度低于一定值时,蜡烛无法燃烧,故正确;
B.蜡烛燃烧生成二氧化碳,所以瓶中二氧化碳的含量增大了,故正确;
C.任何化反应都遵循质量守恒定律,密闭容器内的物质的质量不会改变,故正确;
D.当氧气的体积分数达到15.96%时,蜡烛熄灭,说明此时瓶内仍有氧气,故错误.
故选D.
点评:本题考查了蜡烛的燃烧,完成此题,可以依据蜡烛燃烧的实质结合图示进行.
9.总结化规律要严谨、.下列说法中正确的是( )
A.酸溶液中一定含有氢离子[..]
B.气体受热膨胀是因为温度升高气体分子变大
C.生成盐和水的反应一定是中和反应
D.一定温度下的![]() 浓溶液一定是饱和溶液
浓溶液一定是饱和溶液
考点:酸的化性质;浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系;中和反应及其应用;利用分子与原子的性质分析和解决问题.
专题:物质的微观构成与物质的宏观组成;溶液、浊液与溶解度;常见的酸 酸的通性.
分析:A、根据酸的定义分析;
B、根据分子的性质分析;
C、根据中和反应的定义分析;
D、根据饱和溶液和浓溶液的关系分析.
解答: 解:A、酸电离出的阳离子都是氢离子的化合物,因此酸溶液中一定含有氢离子.故说法正确;
B、气体受热膨胀是因为温度升高,气体分子间隔变大,而分子本身没变.故说法错误;
C、中和反应是酸和碱反应生成盐和水的反应,但生成盐和水的反应不一定是中和反应,酸性氧化物和碱反应也会生成盐和水,如二氧化碳和氢氧化钠反应会生成碳酸钠和水,但是反应物不是酸和碱,不符合中和反应的定义,故说法错误;
D、一定温度下的浓溶液不一定是饱和溶液,也可能是不饱和溶液,故说法错误;
故答案为:A.
点评:本题主要考查了在化中的一些概念的严密性,定义正说是对的,但反过说就不一定对了,要注意叙述的严密性.掌握酸性溶液的特征、分子的性质、中和反应的定义、溶液浓稀与饱和溶液、不饱和溶液的关系是解题的关键.
10.研究表明,木糖醇是一种理想的蔗糖替代品,它具有甜味足、溶解性好、防龋齿,适合糖尿病患者食用的优点.根据木糖醇和蔗糖的溶解度曲线,下列叙述不正确的是( )
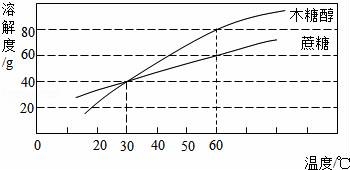 []
[]
A.木糖醇和蔗糖都是易溶物
B.30℃时两种物质的溶液溶质质量分数相等
C.60℃时,40g木糖醇加入50g水,能得到90g溶液
D.在人体正常体温时,木糖醇溶解度大于蔗糖
考点:固体溶解度曲线及其作用;物质的溶解性及影响溶解性的因素;溶质的质量分数、溶解性和溶解度的关系.
专题:溶液、浊液与溶解度.
分析:A、根据易溶物的条件考虑;B、根据饱和溶液的质量分数的计算方法考虑;C、根据溶解度的概念考虑;D、根据某一温度时物质溶解度的比较方法考虑.
解答: 解:A、在20℃,固体物质的溶解度大于10g,为易溶物质,由图示可知,在该温度下两种物质的溶解度都大于10g,故A说法正确;
B、饱和溶液的溶质质量分数:![]() ×100%,因为在30℃时两种物质的溶解度相等,所以饱和溶液的溶质质量分数也相等,但此题“30℃时两种物质的溶液”没有说明是饱和溶液,故B错误;
×100%,因为在30℃时两种物质的溶解度相等,所以饱和溶液的溶质质量分数也相等,但此题“30℃时两种物质的溶液”没有说明是饱和溶液,故B错误;
C、根据溶解度的概念,60℃时,木糖醇的溶解度为80g,故40g木糖醇加入50g水,正好完全溶解,能得到90g溶液,故C说法正确;
D、在人体正常体温即37℃左右,木糖醇溶解度曲线在蔗糖的溶解度曲线的上边,所以在人体正常体温时,木糖醇溶解度大于蔗糖,故D正确.
故选B.
点评:解答本题关键是要知道溶解度曲线表示的意义,知道溶解度如何比较大小,饱和溶液溶质质量分数的计算公式.
二、非选择题
11.在2014年索契冬季奥运会上,中国运动员共获得了九枚奖牌,成为亚洲体坛霸主.
(1)图1是速度滑冰运动![]() 员使用的刀冰鞋.
员使用的刀冰鞋.
①刀冰鞋中含有的金属单质是Al(或Fe)(写化式),属于有机合成材料的是锦纶.
②制造刀冰鞋的铝合金材料具有较好的抗腐蚀性,请用化方程式表示铝具有较好的抗腐蚀性的原因4Al3O2=2Al2O3.
(2)图2是2014年索契冬奥会的火炬,火炬外形像神话传说中的火鸟.采集圣火,在太阳光下将火炬燃料喷口伸向凹面镜焦点位置,打开阀门,火炬将被点燃.火炬能被点燃的原因是温度达到着火点.火炬传递结束后,采用关闭燃气阀门的方法熄灭火炬,其中蕴含的灭火原理是隔离可燃物.
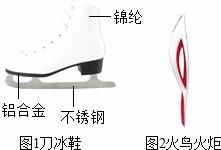
考点:合金与合金的性质;金属的化性质;燃烧与燃烧的条件;灭火的原理和方法;合成材料的使用及其对人和环境的影响.
专题:化与生活.
分析:(1)①根据刀冰鞋的组成材料分析;
②铝在通常情况下能和空气中的氧气反应生成氧化铝;
(2)根据燃烧的条件和灭火原理分析.
解答: 解:(1)①从刀冰鞋的组成材料看,冰鞋中含有的金属单质是铝或铁,属于有机合成材料的是锦纶;
②铝在通常情况下和氧气反应的化方程式为:4Al3O2═2Al2O3;
(2)凹面镜能够聚光,聚光时温度升高,当达到燃料的着火点时,燃料能够燃烧起,所以凹面镜在燃料燃烧中起到的作用是使温度达到燃料的着火点;
关闭燃气阀门后,燃料与氧气隔绝,从而熄灭.
故答案为:(1)①Al(或Fe);锦纶;
②4Al3O2═2Al2O3;
(2)温度达到着火点;隔离可燃物.
点评:物质燃烧需要三个条件:可燃物、与氧气接触、温度达到着火点,这三个条件缺一不可,因此,只要破坏燃烧的条件,就可以实现灭火.
12.化用语是习和交流化知识的通用语言.下列三种物质:
①熟石灰 ②硝酸钾 ③氢氧化铝,请选择合适物质用化式填空:
(1)可用于治疗胃酸过多的是Al(OH)3;(2)用于降低土壤酸性的Ca(OH)2;(3)属于复合肥的是KNO3.
考点:常见碱的特性和用途;常见化肥的种类和作用.
专题:物质的性质与用途.
分析:物质的性质决定物质的用途,根据常见化物质的性质和用途进行分析解答即可.
解答: 解:(1)氢氧化铝能与胃液中的盐酸反应生成氯化铝和水,可用于治疗胃酸过多,其化式为:Al(OH)3.
(2)氢氧化钙具有碱性,属于碱,可用于改良酸性土壤,其化式为:Ca(OH)2.
(3)硝酸钾中含有氮元素和钾元素,属于复合肥,其化式为:KNO3.
故答案为:(1)Al(OH)3;(2)Ca(OH)2;(3)KNO3.
点评:本题难度不大,物质的性质决定物质的用途,掌握常见化物质的性质和用途是正确解答此类题的关键.
13.(1)如图是A、B、C三种物质的溶解度曲线图,看图后回答下列问题:
①三种物质中,溶解度受温度影响最大的是A物质.
②在温度为t1℃时,A、B、C三种物质的溶解度相等.要从C物质的溶液中得到C晶体,最好采用的方法是蒸发溶剂.
(2)日常生活中除去油污的方法很多,下![]() 列现象不属于乳化的是C.
列现象不属于乳化的是C.
A.洗面奶洗去皮肤上的油污 B.洗发精洗去头发上的油污
C.修车工用汽油洗去手上的油污 D.洗洁精洗去餐具上的油污.
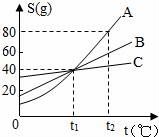
考点:固体溶解度曲线及其作用;乳化现象与乳化作用.
专题:溶液、浊液与溶解度.
分析:(1)依据物质的溶解度曲线可以看出物质的溶解度受温度影响情况;溶解度曲线的交点表示此温度下几种物质的溶解度相同;C物质的溶解度随温度变化不大,最好采取蒸发溶剂的方法得到晶体;
(2)利用乳化与溶解的不同,分析去除油污的几种方法的差异.
解答: 解:(1)①由图可知:三种物质中,溶解度受温度影响最大的是A;
②由图可知:三种物质的溶解度曲线在t1℃时相交于一点,说明此时三种物质的溶解度相等;C物质的溶解度随温度变化不大,最好采取蒸发溶剂的方法得到晶体;
(2)选项C中用汽油洗去手上的油污,是利用汽油能溶解污染而除去油污,此现象是溶解而非乳化;而选项A、B、D都是利用乳化剂使油污、油脂与水形成具有一定稳定性但并不均一的乳浊液而除去,因此,都属于乳化现象;
故答案为:(1)①A; ②t1; 蒸发溶剂; (2)C.
点评:了解溶解度曲线的应用、乳化现象及其形成是解答此题的关键.
14.在通常状况下,氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液俗称氨水.请根据如图回答:

(1)指出上图中仪器a的名称:长颈漏斗.
(2)某同设计了如图A所示的实验:挤压滴管胶头,使滴管中的水进入广口瓶,打开止水夹,你将观察到的现象是烧杯中的溶液会进入集气瓶、酚酞溶液由无色变为红色由此可知氨气易溶于水,且氨水的pH>(填“>”、“=”或“<”).
(3)实验室常用加热氯化氨与消石灰的固体混合物制取氨气,其发生装置可选用上图中C的装置,收集氨气可采用向下排空气法,干燥氨气可选用生石灰( 填“生石灰”或“浓硫酸”).
考点:化性质与物理性质的差别及应用;常用气体的发生装置和收集装置与选取方法;气体的干燥(除水);溶液的酸碱性与pH值的关系.
专题:实验性简答题.
分析:(1)熟悉常见的仪器;
(2)根据氨气的性质以及压强的有关知识进行分析;
(3)实验室制取氨气时需要加热,反应物都是固体,应该选择能够加热的实验装置,氨气易溶于水,不能用排水法收集.
解答: 解:(1)a是长颈漏斗,故填:长颈漏斗;
(2)氨气极易溶于水,因此挤压滴管胶头,滴管中的水进入广口瓶后压强减小,打开止水夹,烧杯中的溶液会进入集气瓶;氨水显碱性,pH大于7,因此酚酞溶液由无色变为红色,故填:烧杯中的溶液会进入集气瓶;酚酞溶液由无色变为红色;>.
(3)实验室制取![]() 氨气时需要加热,反应物都是固体,应该选择C装置制取氨气,氨气的密度比空气小,极易溶于水,只能用向下排气法收集;氨气能与硫酸反应,因此干燥氨气可选用生石灰,故填:C;向下排空气;生石灰.
氨气时需要加热,反应物都是固体,应该选择C装置制取氨气,氨气的密度比空气小,极易溶于水,只能用向下排气法收集;氨气能与硫酸反应,因此干燥氨气可选用生石灰,故填:C;向下排空气;生石灰.
点评:考虑收集气体的方法时,应该从气体的密度、水溶性、是否有毒等方面进行分析、判断,从而找出最好的收集方法.
15.以粗盐(主要成分是NaCl,含有不溶性泥砂、可溶性的MgCl2、CaCl2等杂质)为原料,电解食盐水生产氢氧化钠的简要流程如图:
(1)步骤①除去不溶性杂质,其主要操作有溶解、蒸发.
(2)步骤②除去可溶性杂质,写出其中一个化方程式MgCl22NaOH=Mg(OH)2↓2NaCl或CaCl2Na2CO3=CaCO3↓2NaCl.
(3)写出步骤③中一种单质的名称氯气,工业上可利用本步骤中产生的两种气体生产盐酸,写出盐酸的一种用途除锈.
(4)步骤④中制![]() 得的氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要先用大量的水冲洗再涂上硼酸.
得的氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要先用大量的水冲洗再涂上硼酸.
(5)该流程中可以循环利用的物质是先用大量的水冲洗再涂上硼酸.
考点:氯化钠与粗盐提纯;过滤的原理、方法及其应用;碱的化性质;盐的化性质;书写化方程式.
专题:常见的盐 化肥料.
分析:(1)根据题干提供的信息结合物质的性质进行分析,要将氯化钠溶液变成氯化钠的饱和溶液,可以采用加热蒸发的方法;
(2)根据氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠;氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠解答;
(3)根据电解氯化钠的溶液生成氢氧化钠、氯气、氢气;稀盐酸可用于除锈等解答;
(4)根据氢氧化钠沾到皮肤上要先用大量的水冲洗再涂上硼酸解答;
(5)氢氧化钠可循环利用.
解答: 解:(1)氯化钠溶液经过操作④得到了氯化钠的饱和溶液,则该操作是蒸发,故填:蒸发;
(2)氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠;氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠;故答案:MgCl22NaOH=Mg(OH)2↓2NaCl或CaCl2Na2CO3=CaCO3↓2NaCl
(3)电解氯化钠的溶液生成氢氧化钠、氯气、氢气;稀盐酸可用于除锈等;故答案:氯气;除锈;
(4)氢氧化钠沾到皮肤上要先用大量的水冲洗再涂上硼酸;故答案:先用大量的水冲洗再涂上硼酸;
(5)氢氧化钠可循环利用,故答案:氢氧化![]() 钠.
钠.
点评:本题考查了常见物质间的转化,完成此题,可以依据已有的物质的性质进行.书写反应的化方程式要注意配平.
16.为了测定某品牌小苏打样品中碳酸氢钠的质量分数,兴趣小组进行了如图所示的实验(假设该样品中只含有氯化钠一种杂质).请计算:

(1)生成CO2气体的质量;
(2)样品中碳酸氢钠的质量分数.
考点:根据化反应方程式的计算.
专题:综![]() 合计算(图像型、表格型、情景型计算题).
合计算(图像型、表格型、情景型计算题).
分析:(1)根据质量守恒定律,化反应前后物质的总质量不变,据此可以求出二氧化碳的质量;
(2)根据二氧化碳的质量,利用反应的化方程式进行求算,据此解答即可.
解答: 解:
(1)生成二氧化碳的质量为:10g100g100g﹣205.6g=4.4g
(2)设碳酸氢钠的质量为x
NaHCO3HCl=NaClH2OCO2↑
84 44
x 4.4g
![]()
x=8.4g
样品中碳酸氢钠的质量分数![]() =84%
=84%
答案:
(1)生成二氧化碳的质量4.4g
(2)样品中碳酸氢钠的质量分数84%
点评:本题考查了根据化方程式的计算,完成此题,可以依据反应的化方程式结合题干提供的数据进行.

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...