2018年吉林省东北师大附属中学化学模拟题(精编word版)
为了方便您的阅读请点击全屏查看
第I卷(共50分)
单项选择题(每小题2分,共20分)
下列![]() 物质的分类组合全部正确的是
物质的分类组合全部正确的是
编号 | 强电解质 | 弱电解质 | 非电解质 |
A[来源:学,科,网] | CaCO3 | HF | CI2 |
B | NaHCO3 | H2S | CH3COOH |
C | Ba(OH)2 | HCI | Cu |
D | FeCI3 | NH3H2O | CCI4 |
![]() 反应C(s)+H2O(g) CO(g)+H2(g)在密封容器中进行,下列条件的改变对其反应速率几乎无影响的是
反应C(s)+H2O(g) CO(g)+H2(g)在密封容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半③保持体积不变,充入N2使体系压强增大. ④保持压强不变,充入N2能使容器体积变大
①④ B.②③ C.①③D.②④
下列有关溶液酸碱性的说法正确的是
c(H)=C(OH)的溶液显中性
碱性溶液中,c(H+)小于1.0×10-7mol-L-1
当溶液呈酸性时![]() ,水电离的c(H+)>c(OH)
,水电离的c(H+)>c(OH)
在100°C时,纯水的PH<7,因此显酸性
下列利用相关数据作出的推理或判断正确的是
只利用焓变数据即可判断反应能否自发进行
利用溶液的PH即可判断溶液的酸碱性
可利用反应热数据判断反应速率的大小
可利用平衡常数判断反应进行的程度大小
![]()
![]() 已知人体体液中存在如下平衡:H+HCO3 H2CO CO2H2O.以维持体液
已知人体体液中存在如下平衡:H+HCO3 H2CO CO2H2O.以维持体液![]() 的PH的相对稳定。下列说法中不合理的是
的PH的相对稳定。下列说法中不合理的是
A.强酸性物质进入体液后,上述平衡向右移动,以维持体液的pH的相对稳定
B.当强碱性物质进入体液后,上述平衡向左移动,以维持体液的pH的相对稳定
C.进行呼吸活动时,如CO2进入血液,会使体液的pH减小
D.若静脉滴注大量生理盐水,则体液的pH减小
![]() 在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
A.c(A2![]() ): c(B2):c(AB)=1:1:2
): c(B2):c(AB)=1:1:2
B.容器内的总压不随时间的变化而变化
C.单位时间内生成2nmolAB同时生成nmolB2
D.单位时间内生成nm![]() olA2同时生成nmolB2[来源:]
olA2同时生成nmolB2[来源:]
7.0.6molX气体和0.4mol气体混合欲2L的密封容器中,发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g).5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/L?min,则n的值为()
A.2 B.4 C.1 D.3
![]()
![]() 8.已知下列反应的平衡常数: H2(g)+S(s) H2S(g) K1 S(s)+O2(g)SO2(g) .K2 则反应H2(g)+SO2(g)⇄ O2+H2S(g)的平衡常数为
8.已知下列反应的平衡常数: H2(g)+S(s) H2S(g) K1 S(s)+O2(g)SO2(g) .K2 则反应H2(g)+SO2(g)⇄ O2+H2S(g)的平衡常数为
A.K1+K2 B.K1-K2 C.K1×K2 D.K1/K3
![]() 9.在密封容器中进行发生如下反应:X2(g)+Y2(g) 2Z(g)已知X2Y2、2的起始浓度分别为0.1mol/L 、0.3mol/L、0.2mol/L在一定的条件下,当反应达到平衡时,各物质的浓度有可能是
9.在密封容器中进行发生如下反应:X2(g)+Y2(g) 2Z(g)已知X2Y2、2的起始浓度分别为0.1mol/L 、0.3mol/L、0.2mol/L在一定的条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3mol/L B. Y2为0.35mol/L C. X2为0.2mol/L D. Z为0.4mol/L[来源:.Com]
![]() 10.一定量混合气体在密封容器中发生如下反应:xA(g)+yB(g) nC(g).达到平衡后测得A气体的浓度为0.5 mol/L;保持恒温下将密闭容器的容积扩大1倍,,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
10.一定量混合气体在密封容器中发生如下反应:xA(g)+yB(g) nC(g).达到平衡后测得A气体的浓度为0.5 mol/L;保持恒温下将密闭容器的容积扩大1倍,,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
A.x+y<nB.该化学平衡向右移动C.B的转化率增大 D.A的物质的量增加
二、单项选择(每小题3分,共30分)
11.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大,四种物质在冰醋酸中的电离常数如下:
| HCIO4 | H2SO4 | HCI | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下说法不正确的是
A.在冰醋酸中高氯酸是这四种酸中最强的酸
B.在冰醋酸中这四种酸都没有完全电离
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO![]()
D.酸的强弱![]() 与其本身的结构和溶质的性质有关
与其本身的结构和溶质的性质有关
12.X、Y、Z三中气体,取X和Y按.取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.33% B.40%C.50%D.65%
13.已知室温时.0.1mol/L,是某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A![]() .该溶液中PH=3
.该溶液中PH=3
B.升高温度时,溶液的PH减小
C.此酸的电离平衡常数为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的 106倍。
要证明某一元酸是弱酸,下列方法正确的是
A.将串联一小灯泡的该酸溶液与串联一相同小灯泡的硫酸并联,接通电源后,若该溶液上的灯泡较暗,则说明该酸是弱酸
B .测定0.01mol/L该酸溶液常温下的PH,若PH>2,则说明该酸是弱酸
C .用该酸与金属锌反应,产生气泡较慢,则说明该酸是弱酸
D.中和等体积等,浓度的NAOH溶液消耗该酸的体积小消耗盐酸的体积,则说明该酸是弱酸
![]() 15.已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2molSO2、1molO2,发生反应:2SO2(g)+O2(g) 2SO3(g).△H<0.初始时两容器的温度、体积相同。一段时间后两容器中反应均达到平衡,为使两容器中SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
15.已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2molSO2、1molO2,发生反应:2SO2(g)+O2(g) 2SO3(g).△H<0.初始时两容器的温度、体积相同。一段时间后两容器中反应均达到平衡,为使两容器中SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
A.向乙容器中充入一定量的SO3气体B.向甲容器中充入一定量的氦气
C.升高乙容器的温度D.增大甲容器的压强
下面是某化学研究小组探究外界条件对化学反应速率![]() 和化学平衡影响的图像其中图象和实验结论表达正确的是
和化学平衡影响的图像其中图象和实验结论表达正确的是
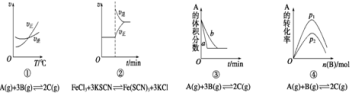
A.①是其他条件一定时,反应速率随温度变化的图象,正反应△H>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象
C.③是在有无催化剂存在下建立的平衡过程图象,B 是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
![]() 17.向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。下列说法中,正确的是( )
17.向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。下列说法中,正确的是( )
A.X代表压强 B.L1 <L2[来源:学|科|网]
C.平衡常数:K(A)=K(B) D.在C点时,CO转化率为75%

![]() 18.工业上,利用CO和H2合成二甲醛:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)。为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是
18.工业上,利用CO和H2合成二甲醛:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)。为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是
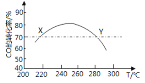
A.X、Y两点对应的CO正反应速率相等
B.合成二甲醚的正反应△H>0
C.反应温度应控制在240℃~260℃之间
D.选择合适催化剂,可以提高CO转化率
19.已知反应2N2O5(g)4N![]() O2(g)+O2(
O2(g)+O2(![]() g)的分解速率表达式为v正=k正.cm(N2O5),k正是与温度有关的常数,340K时实验测得的有关数据如下
g)的分解速率表达式为v正=k正.cm(N2O5),k正是与温度有关的常数,340K时实验测得的有关数据如下![]() :
:
t/min12 3 4
c(N2O5)(mol/L)-10.133 0.080 0.057 0.040
V正mol/L-1·min-10.04660.028 0.020 0.014
下列有关叙述不正确的是
A.340K时,速率表达式中m=1
B.340K时,速率表达式中k正 ≈0.35min-1
C.340K时,若c(N2O5)=0.100mol/L+1,则v正 ≈0.035mol/L-1·min
D.若t=2min时升高温度,则m不变,k正减小
20.反应aM(g)+bN(g)cP![]() (g)+dO(g)达到化学平衡时,M的体积分数y(M)与反应条件的关系如下图所示.其中:Z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是
(g)+dO(g)达到化学平衡时,M的体积分数y(M)与反应条件的关系如下图所示.其中:Z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是
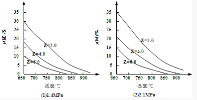
A.同温同压同Z时,加入催化剂,达到化学平衡时Q的体积分数一定增加
B.同温同压时,增加Z,达到化学平衡时Q的体积分数一定增加
C.同温同Z时,增加压强,达到化学平衡时Q的体积分数一定增加
D.同压同Z时,升高温度,达到化学平衡时Q的体积分数一定增加
第Ⅱ卷(共50分)
三、填空题(本题有3小题,共50分)
(10分)化学反应速率是描述化学反应进行快慢程度的物理量。为探讨化学反应速率的影响因素,某同学设计的实验方案如下:(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s
| |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
该实验进行的目的是;
淀粉溶液的作用是 。
(2)表中Vx=__________mL,t1、t2、t3由大到小顺序为__;试推测该实验结论: 。
22.(16分)25℃时,部分物质的电离平衡常数如下表示:
化学式 | HA | H2B | HC |
电离平衡常数 | 1.7×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8
|
请回答下列问题:
HA、H2B、HC的酸性由强到弱的顺序为
。
(2)同浓度A、HB-、B2+、C结合H+的能力由强到弱的顺序。
(3)常温下,0.1mol•L-1的HA溶液加水稀释过程中,下列表达式的数据一定变小的是______(填字母序号,下同)
A.c(H+) ![]() B.c(H+)/c(HA) C.c(H+)•c(OH- )D.c(OH-)/c(H+)
B.c(H+)/c(HA) C.c(H+)•c(OH- )D.c(OH-)/c(H+)
若该溶液升高温度,上述4种表达式得数据增大的是。
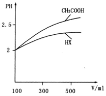
体积均为10mL pH=2的HA与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)HA的电离平衡常数.理由是:______.稀释后,HX溶液中由水![]() 电离出来的c(H-) (填“大于”、“小于”或“等于”)HA溶液中由水电离出来的c(H+),理由是
电离出来的c(H-) (填“大于”、“小于”或“等于”)HA溶液中由水电离出来的c(H+),理由是
23.(24分)化学反应原理在科研和生产中有广泛应用。
Ⅰ.利用“化学蒸气转移法”制备TaS2晶体,发生如下![]() 反应:
反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g)
该反应的平衡常数表达式K= .
某温度时,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),若I2(g)的平衡转化率为80%,此温度时该反应的K值为 。
在此温度下,向另一恒容容器中加入等质量I2(g)、TaI4(g)、S2(g)和足量的TaS2(s),此时r(正)r(逆) (填“大于”、“等于”或“小于”):平衡时 I2(g)的体积百分含量为 。
Ⅱ.制备甲醇反应如下:CO(g)+2H2(g) CH3OH(g)
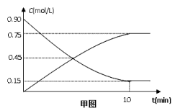
甲图是反应时CO和CH3OH(g)的浓度随时间t的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)=。
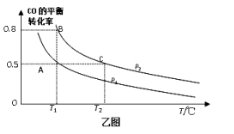
(5)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法不能判断该反应达到化学平衡状态的是_____。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B、C三点化学反应速率由大到小顺序是______。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)=___________L。

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...