各位同学在查看时请点击全屏查看
2017年贵阳中考化学试题
一、化学试题选择题:本题包括6个小题,每题只有一个选项符合题意,每小题2分,共12分.
1.2017年6月18日为首个“贵州生态日”,同期举行的生态文明贵阳国际研讨会,以“走向生态文明新时代:共享绿色红利”为主题.下列做法不符合这一主题的是()
A.选择公共交通绿![]() 色出行 B.工厂废酸液直接排放
色出行 B.工厂废酸液直接排放
C.自带布袋购物减少白色污染 D.少用一次性餐具节约资源
2.端午节吃粽子是传统习俗.贵阳特色粽子的主要配料为下列四种物质,其中富含糖类的是()
A.糯米 B.火腿肉 C.蛋黄 D.食盐
3.在“一带一路”伟大战略实施中,代表中国智造的高铁走在了前列.高铁动车与电路连接的石墨电刷没有用到石墨的性质是()
A.稳定性 B.滑腻感 C.还原性 D.导电性
4.毒品带给人类的只会是毁灭,所以我们要珍爱生命,远离毒品.毒品K粉会对大脑造成永久损害,其主要成分是盐酸氯胺酮(化学式为C13H16ONCl).则有关盐酸氯胺酮的下列说法不正确的是()
A.该物质是化合物
B.该物质由5种元素组成
C.该物质中C与H元素的质量比是13:16
D.该物质一个分子含有32个原子
5.下列实验的操作或设计正确的是()
A.药品取用:将试管竖直,垂直放入锌粒[来源:Z,xx,k.Com]
B.区别物质:用pH试纸可以区别两种不同浓度的NaCl溶液
C.气体净化:除去CO2中混有的少量CO,可通入O2点燃
D.气体收集:CO2和O2密度比空气大,故都能用向上排空气法收集
6.某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计了如图所示实验.

则下列说法正确的是()
A.a、b溶液一定只含两种溶质
B.b溶液中一定有NaOH和Na2CO3
C.白色固体一定不是纯净物
D.干燥剂一定由NaOH和CaCl2组成
二、化学非选择题:本题包括7个小题,共48分.
7.(6分)在《贵阳市“十三五”生态文明建设专项规划》中以碧水、蓝天、清洁、田园、绿地等五大计划推进生态文明建设.我们是生态文明建设的主人,应积极、主动参与其中.
请从化学视角回答下列问题.
(1)蓝天计划﹣保护贵阳好空气.空气中含有的主要气体是 ,保护爽爽贵阳好空气,你的一条建议是 .
(2)清洁计划﹣控制固体废物污染.如何收废弃物:啤酒瓶、矿泉水瓶、铜导线、废报纸、废铁钉等,其中属于金属废弃物的是 .若要完成金属能与酸发生反应的家庭小实验,除了用白醋外,还需用到上述废弃物中的 .
(3)田园计划﹣打造清洁田园.合理施用化肥,常用的化肥有尿素[CO(NH2)2]、氯化钾(KCl)、磷酸二氢钙[Ca(H2PO4)2]、硝酸铵(NH4NO3),其中属于钾肥的是 ,属于氮肥且含量较高的是 .
8.(6分)建立宏观﹣微观的联系是化学学习的重要思想.阅读下列材料,回答问题.
材料:2017年5月18日,我国试采可燃冰成功,这将点亮新能源时代曙光.可燃冰是天然气(甲烷CH4)和水在高压低温条件下形成的类冰状物质,1体积可燃冰可释放出约164体积的天然气![]() ,可燃冰有储量巨大、高效清洁、燃烧值高的特点.
,可燃冰有储量巨大、高效清洁、燃烧值高的特点.
(1)甲烷是 (填“有机物”或“无机物”),对“1体积可燃冰可释放出约164体积的天然气”体积明显增大的微观解释是 .
(2)如图是甲烷燃烧时反应的微观示意图.

就该反应,从质量守恒角度看,请在图方框中补充画出微观粒子,完善微观示意图;从微观角度看,没有发生变化的是 ;从能量角度看,能量变化是 .
(3)如图所示的反应是氧化反应,其特征是反应前后有元素化合价的变化,则反应中发生化合价变化的元素有 .
9.(8分)根据下列实验要求回答问题.
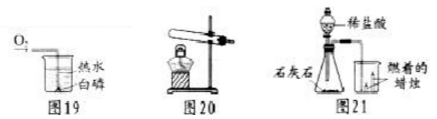
(1)图19实验能证明可燃物燃烧需要的条件之一是 .白磷燃烧的化学方程式为 ,反应的基本类型为 .
(2)若要用图20装置制取实验所需氧气,发生反应的化学方程式是 .
(3)用图21所示装置制取二氧化碳并探究其性质,则:锥形瓶中发生反应的化学方程式为 ,烧杯中观察到的现象是 ;若用该装置模拟灭火器(产生CO2)灭火,对实验应进行的调整是 ,其灭火的原理是 .
10.(8分)金属与生活密切![]() 相关.阅读下列材料,回答问题.
相关.阅读下列材料,回答问题.
材料一:合金是人类应用最早的金属材料.如青铜、黄铜(铜、锌合金,![]() 外观与黄金极其相似).合金比组成它的纯金属有更多优良性能,如抗腐蚀性好、硬度大等.
外观与黄金极其相似).合金比组成它的纯金属有更多优良性能,如抗腐蚀性好、硬度大等.
材料二:锂是银白色固体、质软、自然界密度最小的金属,跟水反应生成氢气和氢氧化锂.在电池、航空航天等领域有广泛的用途.
材料三:锂的原子结构示意图及他与钠在周期表中的信息如图所示.

(1)用黄铜片在纯铜片上刻画 (填“会”或“不会”)留下痕迹.一块由黄铜冒充的黄金,检验其真伪发生反应的化学方程式为 .
(2)金属锂的物理性质有 ;金属锂与钠有相似的化学性质,其原因是 .氢氧化锂与二氧化碳反应的化学方程式为 ,在航天舱内如果要吸收航天员呼出的二氧化碳气体,用氢氧化锂比氢氧化钠更理想,其原因是 .
(3)将一定量的铜和锌同时投入硝酸银溶液,充分反应后过滤,得到固体和蓝色滤液.由此,能否判断金属活动性:Zn>Cu>Ag,说明理由 .
11.(7分)为探究酸的性质,同学们设计了如下实验,请你参与.
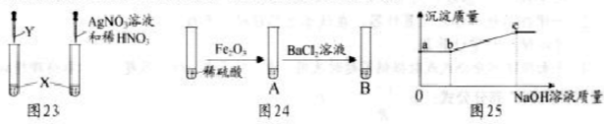
检验物质.按图23实验,可确定X是盐酸,则Y可以是 .
(1)确定溶质成分.由图24实验,A中固体全部溶解,B中有白色沉淀产生,得出结论:A中溶质只有硫酸铁.有同学认为该结论不合理.接着向试管B中滴加氢氧化钠溶液,且产生沉淀的量随氢氧化钠溶液量的关系如图25所示.则:A中溶质有 .实验中,A中发生反应的化学方程式为 ;a~b段对应溶液中一定发生反应的化学方程式为 ;c点对应溶液中含有溶质可能的组成有 .
(2![]() )由以上实验总结酸的化学性质有 .
)由以上实验总结酸的化学性质有 .
12.(10分)生命的孕育和维系需要水,科学研究离不开水.请你完成下列探究.
探究一:用水作溶剂.在盛有5ml水和5ml汽油的两只试管中各加入1~2小粒高锰酸钾,可观察到的现象是 ,结论:同一种物质在不同溶剂中的溶解性不同.
探究二:用水区别物质.自选两种白色固体,用水区别它们,设计实验完成下表内容.
两种白色固体 | 主要操作、现象和结论 |
|
|
探究三:溶质在水中的溶解与结晶.
【查阅资料】20℃时,五种物质的溶解度如下表.
物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 | Na2CO3 |
溶解度/g | 36.0 | 21.0 | 37.2 | 9.6[来源:Zxxk.Com] | 21.5 |
相同温度下,不同溶质同时溶解在同一溶剂中,溶解度不变.
【提出问题】20℃时,将11.7gNaCl和15.8gNH4HCO3同时放入盛有100g水的烧杯中,充分搅拌,静置,有晶体析出(温度仍为20℃).析出的晶体是什么?
【设计实验】设计方案,并进行实验.
(1)取少量晶体与熟石灰粉末混合、研磨,无明显现象.实验目的是 .[来源:Z#xx#k.Com]
(2)取少量晶体于试管中,加入 ,现象为 .
【实验结论】(3)析出的晶体是 ,晶体的质量为 g.
【实验拓展】(4)析出晶体的原因是 .
13.(3分)某工厂需要20kg氢气作原料.若用电解水的方法制取这些氢气,同时生成氧气的质量是多少?
2017年贵阳中考化学试题参考答案
一、化学选择题:本题包括6个小题,每题只有一个选项符合题意,每小题2分,共12分.
1.B
2、A.
3.C.
4.C.
5.D.
6.B.
二、化学非选择题:本题包括7个小题,共48分.
7.(1)氮气、氧气;多植树(节能减排,绿色出行);
(2)铜导线、废铁钉; 废铁钉、啤酒瓶(矿泉水瓶);
(3)氯化钾; 尿素.
8.解:(1)甲烷是一种含碳元素的化合物,属于有机物,1体积可燃冰可释放出约164体积的天然气说明了分子间隔增大;故填:有机物;分子间的间隔增大;
(2)甲烷与氧气在点燃的条件下反应生成二氧化碳和水,化学方程式为:CH4+2O2![]() CO2+2H2O,根据各物质化学式前面的化学计量数可知,该反应的微观示意图为
CO2+2H2O,根据各物质化学式前面的化学计量数可知,该反应的微观示意图为![]() ;在化学反应中原子的种类与数目不变;甲烷燃烧的过程中化学能转化为热能;故填:
;在化学反应中原子的种类与数目不变;甲烷燃烧的过程中化学能转化为热能;故填:![]() ;原子种类、原子数目;化学能转变为热能;
;原子种类、原子数目;化学能转变为热能;
(3)在反应前,甲烷中碳元素显﹣4价,氢元素显+1价,氧气中氧元素的化合价为0,而反应后二氧化碳中碳元素显+4价,氧元素显﹣2价,水中氢元素显+1价,氧元素显﹣2价,可见反应前后碳元素与氧元素的化合价发生了变化;故填:C、O.
9.解:(1)热水中的白磷具有可燃性,温度也达到了其着火点,但是没有燃烧,原因是没有与氧气接触,通入氧气后白磷在水下燃烧,进一步证明了燃烧需要氧气;磷与氧气在点燃的条件下反应生成五氧化二磷,该反应符合“多变一”的特点,属于化合反应;故填:需要氧气;4P+5O2![]() 2P2O5;化合反应;
2P2O5;化合反应;
(2)该装置适用于固体加热制取氧气,试管口没有棉花团,所以是在二氧化锰的催化作用下加热氯酸钾制取氧气,同时生成氯化钾;故填:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)石灰石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水和二氧化碳;由于二氧化碳的密度比空气大,不燃烧也不支持燃烧,所以观察到烧杯中位置低的蜡烛先熄灭、位置高的后熄灭;若用该装置模拟灭火器(产生CO2)灭火,就需要产生二氧化碳的速率加快,反应更剧烈一些,可以改用粉末状的石灰石或用碳酸钠粉末,将稀盐酸改为浓盐酸;二氧化碳灭火的原理是能够覆盖在可燃物的表面,隔绝了氧气;故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;位置低的蜡![]() 烛先熄灭、位置高的后熄灭;用粉末状石灰石(或用浓盐酸或用碳酸钠粉末);隔绝空气(或氧气).
烛先熄灭、位置高的后熄灭;用粉末状石灰石(或用浓盐酸或用碳酸钠粉末);隔绝空气(或氧气).
10.解:(1)合金的硬度比组成的纯金属的硬度大,所以用黄铜片在纯铜片上刻画会留下痕迹,黄铜中的锌和盐酸反应生成氯化锌和氢气,化学方程式为:Zn+2HCl=ZnCl2+H2↑;
(2)物理性质是不需要发生化学变化就表现出来的性质,所以金属锂的物理性质有:银白色、固体、质软、密度小,元素的化学性质与原子的最外层电子数有关,所以金属锂与钠有相似的化学性质,其原因是:原子最外层电子数相同,二氧化碳和氢氧化锂反应生成碳酸锂和水,化学方程式为:CO2+2LiOH=Li2CO![]() 3+H2O,每80份质量的氢氧化钠、每48份质量的氢氧化锂会吸收44份质量的二氧化碳,所以用氢氧化锂比氢氧化钠更理想,其原因是:相同质量的氢氧化锂吸收二氧化碳的质量是氢氧化钠的1.67倍;
3+H2O,每80份质量的氢氧化钠、每48份质量的氢氧化锂会吸收44份质量的二氧化碳,所以用氢氧化锂比氢氧化钠更理想,其原因是:相同质量的氢氧化锂吸收二氧化碳的质量是氢氧化钠的1.67倍;
(3)排在前面的金属可以将排在后面的金属从其盐溶液中置换出来,所以将一定量的铜和锌同时投入硝酸银溶液,充分反应后过滤,得到固体和蓝色滤液,能判断金属活动性:Zn>Cu>Ag,理由是:由于溶液呈蓝色,则固体一定无锌.若固体只有金属银,无法判断锌和铜的活动性,则无法判断三种金属的活动性;若固体为银白色的银和红色的铜,溶液中一定有Zn2+、Cu2+,说明锌可以置换银,铜不能置换锌,银不能置换铜,则说明金属活动性:Zn>Cu>Ag.
故答案为:(1)会,Zn+2HCl=ZnC![]() l2+H2↑;
l2+H2↑;
(2)银白色、固体、质软、密度小,原子最外层电子数相同,CO2+2LiOH=Li2CO3+H2O,相同质量的氢氧化锂吸收二氧化碳的质量是氢氧化钠的1.67倍;
(3)由于溶液呈蓝色,则固体一定无锌.若固体只有金属银,无法判断锌和铜的活动性,则无法判断三种金属的活动性;若固体为银白色的银和红色的铜,溶液中一定有Zn2+、Cu2+,说明锌可以置换银,铜不能置换锌,银不能置换铜,则说明金属活动性:Zn>Cu>Ag.
11.解:氢离子和碳酸根离子反应会生成二氧化碳气体,氯离子和银离子反应生成氯化银沉淀,所以按图1实验,可确定X是盐酸,则Y可以是碳酸钠溶液;[来源:Z_xx_k.Com]
(1)稀硫酸和氧化铁反应生成硫酸铁和水,硫酸铁和氯化钡反应生成硫酸钡沉淀和氯化铁,氯化钡也会与稀硫酸反应生成硫酸钡沉淀和盐酸,a~b段沉淀质量没有明显变化,所以一定有盐![]() 酸和氢氧化钠的反应,可能有硫酸和氢氧化钠的反应,所以A试管的溶质中一定含有硫酸、硫酸铁,化学式为:H2SO4、Fe2(SO4)3,实验中,A中发
酸和氢氧化钠的反应,可能有硫酸和氢氧化钠的反应,所以A试管的溶质中一定含有硫酸、硫酸铁,化学式为:H2SO4、Fe2(SO4)3,实验中,A中发![]() 生的反应是氧化铁和硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,a~b段对应溶液中一定发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O,所以c点对应溶液中含有溶质可能的组成有:NaCl;NaCl,BaCl2;NaCl,Na2SO4;
生的反应是氧化铁和硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,a~b段对应溶液中一定发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O,所以c点对应溶液中含有溶质可能的组成有:NaCl;NaCl,BaCl2;NaCl,Na2SO4;
(2)通过分析上面酸发生的反应可知,酸的化学性质有:酸能与盐、金属氧化物、碱反应.
故答案为:(1)碳酸钠溶液;
(2)H2SO4、Fe2(SO4)3,Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
NaOH+HCl=NaCl+H2O,NaCl;NaCl,BaCl2;NaCl,Na2SO4;
(3)酸能与盐、金属氧化物、碱反应.
12.解:探究一:在盛有5ml水和5ml汽油的两只试管中各加入1~2小粒高锰酸钾,可观察到的现象是高锰酸钾溶于水形成紫红色溶液,而高锰酸钾难溶于汽油,结论:同一种物质在不同溶剂中的溶解性不同;
探究二:碳酸钙难溶于水,氧化钙和水反应生成氢氧化钙,放出热量,所以
两种白色固体 | 主要操作、现象和结论 |
碳 | 分别将两种固体加水溶解,难溶于水的是碳酸钙,与水剧烈反应且有热量放出的是氧化钙 |
探究三:(1)铵态氮肥和碱混合研磨会生成有刺激性气味的氨气,所以取少量晶体与熟石灰粉末混合、研磨,无明显现象,实验目的是:证明晶体不是氯化铵;
(2)碳酸盐和盐酸反应生成二氧化碳气体,所以取少量晶体于试管中,加入盐酸,现象为:有无色气体产生;
(3)11.7gNaCl和15.8gNH4HCO3同时放入盛有1![]() 00g水的烧杯中,交换成分可以得到16
00g水的烧杯中,交换成分可以得到16![]() .8g的碳酸氢钠和10.7g的氯化铵,
.8g的碳酸氢钠和10.7g的氯化铵,
物质 | NaCl | NH4HCO3 | NH4Cl [来源:学科网] | NaHCO3 | Na2CO3 |
溶解度/g | 36.0 | 21.0 | 37.2 | 9.6 | 21.5 |
所以析出的晶体是NaHCO3,晶体的质量为:1![]() 6.8g﹣9.6g=7.2g;
6.8g﹣9.6g=7.2g;
(4)11.7gNaCl和15.8gNH4HCO3同时放入盛有100g水的烧杯中,交换成分可以得到16.8g的碳酸氢钠和10.7g的氯化铵,所以析出晶体的原因是:NaCl和NH4HCO3溶于水未达饱和,所以不能以晶体析出,它们在水中解离出Na+、Cl﹣、NH4+、HCO3﹣,阴阳离子运动结合成NaHCO3和NH4Cl,由于NH4Cl溶解度较大,未达饱和,故不能析出,但NaHCO3的溶解度小,且溶液已达饱和,所以过多的NaHCO3以晶体形式析出.
故答案为:探究一:高锰酸钾溶于水形成紫红色溶液,而高锰酸钾难溶于汽油;
探究二:
两种白色固体 | 主要操作、现象和结论 |
碳酸钙、氧化钙 | 分别将两种固体加水溶解,难溶于水的是碳酸钙,与水剧烈反应且有热量放出的是氧化钙 |
探究三:(1)证明晶体不是氯化铵;
(2)盐酸,有无色气体产生;
(3)NaHCO3,7.2;
(4)NaCl和NH4HCO3溶于水未达饱和,所以不能以晶体析出,它们在水中解离出Na+、Cl﹣、NH4+、HCO3﹣,阴阳离子运动结合成NaHCO3 和NH4Cl,由于NH4Cl溶解度较大,未达饱和,故不能析出,但NaHCO3的溶解度小,且溶液已达饱和,所以过多的NaHCO3以晶体形式析出.
13.解:设生成的氧气的质量为x
2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
4 32
20kg x
![]() =
=![]()
x=160kg
答:生成的氧气的质量为160kg.

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...